Grüße chemweazle,
Zur Räumlichen Anordnung von Elektronenpaaren in Dreifachbindungssystemen, HCN und z.B. Ethin
Der räumliche Bau von Molekülen Ein Schüler formuliert für die räumliche Struktur der Blausäure HCN folgende Erklärung: ,, Die vier Elektronenpaare um das Kohlenstoff-Atom sind tetraedisch angeordnet, weil sich diese Elektronenpaare so optimal abstoßen``. Finde den Denkfehler und formulieren ein sachlich zutreffende Aussage.
Könnte mir jemand erklären warum es nicht tetraedisch ist und was ist denn ist ? Dankeschön schonmal !
Schnellantwort: Wenn an einem Atom 3 von den insgesamt 4 Elektronenpaaren sich an einer Dreifach-Bindung beteiligen, ist geometrisch keine tetraedrische Anordnung aller 4 Elektronenpaare zueinander möglich.
Das gilt auch bei der Beteiligung an einer Doppelbindung, auch hier ist aus geometrischen Gründen keine tetraedrische, räumliche Anordnung der 4 Elektronenpaare am Kohlenstoffatom möglich.
Das Cyanwasserstoff-Molekül, ( H—C≡N ), besitzt eine C-N-Dreifachbindung, somit können die Elektronenpaare am Kohlenstoffatom und am Stickstoffatom nur linear und nicht tetraedrisch angeordnet sein.
Der Kohlenstoff ist mit einer Einfachbindung an ein Wasserstoffatom gebunden (H—C ) und mit einer Dreifachbindung an das Stickstoffatom gebunden (C≡N ).
Das Cyanwasserstoff-Molekül ist, von der geometrischen Gestalt her gesehen, ein lineares Molekül, wie das gleichstrukturierte Acetylen( Ethin ), H—C≡C—H .
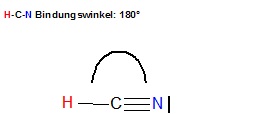
Der eingeschlossene Winkel zwischen der H-C-Einfachbindung und der C-N-Dreifachbindung beträgt 180° und kann somit nicht Winkelwerte, gemessen in Grad, für Tetraedrische Anordnungen der Elektronenpaare um die 109° annehmen.
Konstitutionsformel für HCN:
Skizze
Text erkannt:
H-C-N Bindung swinkel: \( 180^{\circ} \)
Bei der C-N-Dreifachbindung liegen 3 Elektronenpaare quasi parallel zueinander und das vierte vom Kohlenstoffatom ausgehende Elektronenpaar hat einen Winkel von 180 Grad zu den 3 Elektronenpaaren der C-N-Dreifachbindung.
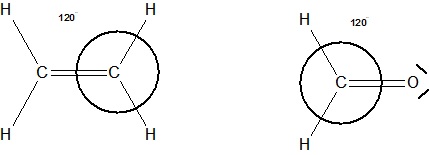
Auch bei Molekülen mit Kohlenstoff-Doppelbindungen, Alkene, Aldehyde , Ketone liegen 2 der 4 Elektronenpaare vom Kohlenstoff parallel, die sich an der Doppelbindung beteiligen.
Die restlichen 2 verbleibenden Elektronenpaare, die nicht an der Doppelbindung beteiligt sind, sind in etwa einen 120°-Winkel zu den Elektronenpaaren der Doppelbindung angeordnet.
Sie sind trigonal-planar angeordnet.
Skizze zu Ethen und Formaldehyd