Grüße chemweazle,
Welches sind die möglichen Zwischenprodukte von Anillin?
1. Oxidation von Anillin (Aminobenzen) kann in 2 Schritten erfolgen. Welches sind die möglichen Zwischenprodukte?
Die Nitroso-Verbindung, süßlicher Geruch, monomer: Ph-N=O, dimer: cis und trans- Ph-N(+)O(-)=N(+)O(-)-Ph (blau-grüne Farbe)
"Azoxybenzen"
Ehrlich-Sachs-Reaktion Aza-analoge Iminkondensation der Monomer-Form des Nitrosyls mit einem prim. Amin, dem Anilin, zum Diazo-Benzen, cis- und trans- Diastereomeren-Gemisch
Ph-NH2 + O=N-Ph ⇌ Ph-N=N-Ph + H2O
Weitere Oxidation des Diazobenzens zum sogenannten Azoxy-Benzen.
Ph-N=N(+)O(-)-Ph
Hydrolyse des Azoxy-Benzens zu N-Phenylhydroxylamin und Nitrosobenzen
Ph-N=N(+)O(-)-Ph + H2O ⇌ Ph-NH-OH + O=N-Ph
Oxidation des Nitrosobenzens zum Nitrobenzen, Ph-NO2
Weiteroxidation zum Endprodukt Nitrobenzen, Ph-NO2
Skizze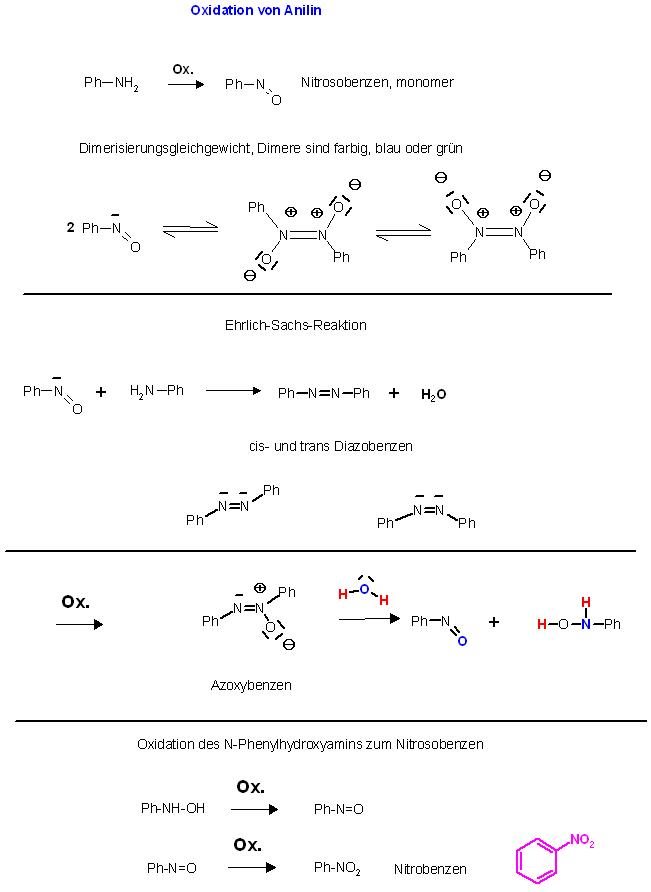
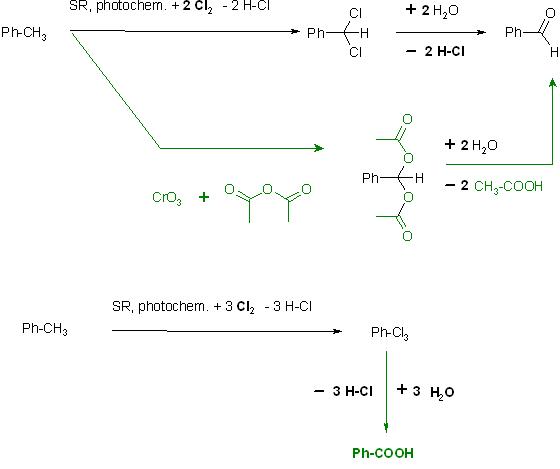
2. Oxidation von Toluol? (Methylbenzen) Was entsteht daraus und welche Zwischenstufen?
a). mit Chlor, photochem. SR-Reaktion zu Cl,Cl-Acetal des Benzaldehyds und anschl. Hydrolyse zum Benzaldehyd
Ph-CH3 + 2 Cl2 → Ph-CHCl2 + 2 H-Cl
Ph-CHCl2 + 2 H2O → Ph-CH=O + 2 H-Cl
Oder Weitere Oxidation mit Chlor zum Trichlormethyl-Benzen, anschl. Hydrolyse liefert die Benzoësäure
Ph-CH3 + 3 Cl2 → Ph-CCl3 + 3 H-Cl
Ph-CCl3 + 3 → 3 H2O → Ph-C=O-OH + 3 H-Cl
b). Etard-Reaktion, Oxidation von Toluen mit Chromtrioxid in Acetanhydrid zum O,O-Bis-acetyl-acetal des Benzaldehyds
Ph-CH3 mit CrO3 + (CH3CO)2O → Ph-CH(O-(C=O)-CH3)2
Ph-CH(O-(C=O)-CH3)2 + 2 H2O → Ph-CH=O + 2 HO-(C=O)-CH3
Skizze
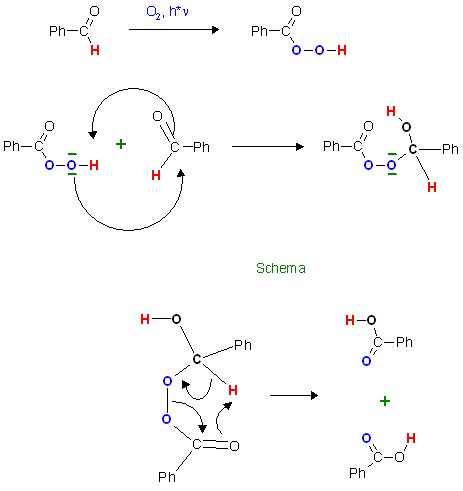
Zum Schluß, die Bayer-Villiger-Oxidation von Aldehyden zu Carbonsäuren mit durch Licht angeregtem Luftsauerstoff,
Zwischenprodukt: Peroxycarbonsäure, R-(C=O)-O-O-H, durch formalen Einschub des O2-Moleküls in die C-H-Bindung des Aldehyds zur Peroxycarbonsäure
Ph-(C=O)-H + O2 → Ph-(C=O)-O-O-H
Addition der Peroxo-Gruppe an das Aldehyd-C-Atom unter Bildung eines Peroxo-Acetals als witeres Zwischenprodukt und anschl. 1,2-H-Verschebung unter Trennung der O-O-Bindung führt zu den 2 Equivalenten Carbonsäure
Ph-(C=O)-O-O-H + Ph-(C=O)-H → 2 Ph-(C=O)-OH
Skizze
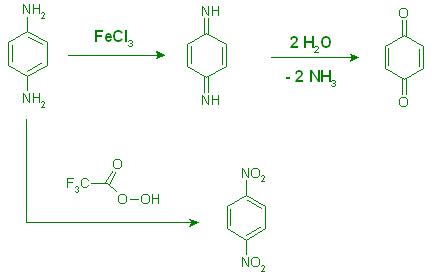
3. Oxidieren sie p-Diaminobenzen. Was ist das mögliche Endprodukt?
Richtig, z.B. mit FeCl3 kann man u.a.auch das para - Chinon-diimin erhalten, nach anschl. Hydrolyse das p-Chinon
1,4-2HN-C6H4-NH2 Ox. mit FeCl3 → 1,4- H-N=C6H4=N-H + 2 H2O → 1,4- O=C6H4=O + 2 NH3
Mit Peroxytrifluoressigsäure, CF3-(C=O)-O-O-H, erhält man das 1,4- Dinitro-Benzen.
Skizze