Grüße chemweazle,
ich habe hier jetzt keinen Reaktionsmechanismus erläutert, sondern nur die Art der Gesamtreaktion.
Zeigen sie die Umsetzung von Acetophenon mit Essigsäurechlorid
Essigsäurechlorid, Acetylchlorid, Ethansäurechlorid, Ethanoylchlorid : CH3-(C=O)-Cl
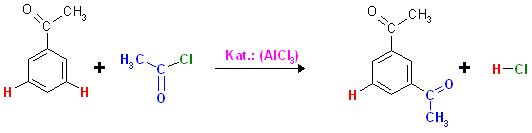
Aufgabe: Zeigen sie die Umsetzung von Acetophenon mit Essigsäurechlorid unter Anwesenheit der Lewis-Säure AlCl3 mit anschließender wässriger Aufarbeitung. Begründen sie mit der Regioselektivität der Reaktion.
Hier geht es um eine Elektrophile Substitution an Acetophenon, SE-Reaktion.
Acetophenon, Methyl-Phenylketon, Phenyl-Ethanon : C6H5-(C=O)-CH3
Es ist die Friedel-Crafts-Acylierung, hierbei wird ein H-Atom des Phenyrests durch einen Acylrest, R-CO-Rest ersetzt, hier in diesem Fall ist es der Acetylrest, CH3-CO- .
Als Katalysator dient hier wasserfreies Aluminiumchlorid, auch wasserfreies Eisen(III)chlorid wird ebenfalls hierfür verwendet.
Es gibt noch die Friedel-Crafts-Alkylierung bei der ein H-Atom durch einen Alkylrest ersetzt(substituiert) wird. Auch hierbei wird AlCl3 oder FeCl3 als Katalysator verwendet.
Anstelle eines Carbonsäurechlorids werden in der Regel Halogenalkane eingesetzt.
Zur Regioselektivität
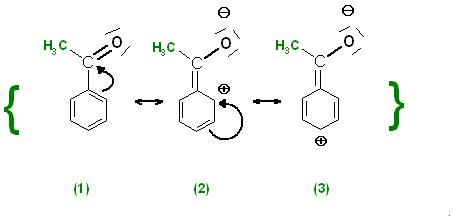
Acetophenon ist ein sogenannter "Elektronenmangel-Aromat", der Acetylrest mit der Ketogruppe, (CO-Gruppe), übt einen starken -M-Effekt auf das sog. Aromatische π-System aus.
Die Elektronendichte wird an allen Positionen, ortho-, meta- und para-Position durch die Ketogruppen stark herabgesetzt.
In den beiden meta-Positionen wird die Elektronendichte am wenigsten verringert.
Das hat zur Folge, daß eine Elektrophile Substitution bei Elektronen-Mangel-Aromaten, das sind die Aromaten mit -M-Substituenten, in einer der beiden meta-Positionen stattfindet.
Es entsteht das sog. "1,3-Diacetyl-Benzen", "3-Acetyl-Acetophenon", "meta-Acetyl-Acetophenon" .
Die -M-Effekt ausübenden Substituenten dirigieren die Substitution in die meta-Stellung des Phenylrests.
Beim Acetophenon wird also in der meta-Stellung ein H-Atom durch einen Acetylrest ersetzt.
Das gilt für alle Elektronenmangel-Aromaten, z.B. : Benzonitril, C6H5-C≡N, Nitrobenzen, C6H5-NO2, Benzaldehyd, C6H5-CH=O, Bezoësäureester, C6H5-(C=O)-OR etc.
Friedel-Crafts-Acylierungs-Reaktion
Ein Blick auf einige der sog. "Mesomeren Grenzformeln" zeigt, daß die positive Ladung in den 3 ausgewählten Grenzformeln nur in der para-Position und in den beiden ortho-Positionen vorkommt, aber nicht in der meta-Stellung. Das verdeutlicht, daß in den beiden meta-Positionen die Elektronendichte am wenigsten verringert wird.
Skizze von 3 ausgewählten Grenzformeln des Acetophenons