Grüße von chemweazle,
Zum Aufgabenblock F, aber demnächst nur jede Frage einzeln posten, gemäß unserer Forumsregeln,
1) Geben Sie die Strukturmerkmale von Salicysäure an und ordnen Sie sie einer Stoffklasse zu.
ortho-Hydoxy-benzoësäure, ortho-hydroxy-phenyl-carbonsäure, Stoffgruppe Carbonsäuren, spezieller: aromatische Carbonsäuren, Hydroxycarbonsäuren
Die Salicylsäure wirkt bei der Herstellung von Acetylsalicylsäure als Alkohol, Phenol.
Bei der Herstellung von Salicylsäuremethylester, Wintergrünöl wirkt sie als Carbonsäurederivat.
2) a)Stellen Sie die Reaktionsgleichung für die Synthese von Essigsäureanhydrid auf.
Labormethode zur Darstellung von Acetanhydrid(Essigsäureanhydrid, Ethansäureanhydrid), ausgehend von der Säure(Carbonsäure) und dem Säurechlorid(Carbonsäurechlorid)
CH3-(C=O)-O-H + Cl-C=O)-CH3 → CH3-(C=O)-O-(C=O)-CH3 + H-Cl(g) ↑
b) Nennen Sie den Reaktionstyp und begründen Sie den Namen von Essigsäureanhydrid.
Anhydridbildung durch Umsetzung von Carbonsäurechloriden mit Carbonsäuren zum Anhydrid.
Es lassen sich auch sog. "Gemischte Carbonsäure-Anhydride" herstellen.
z.B.: CH3-(C=O)-Cl + H-O-(O=C)-C6H5 → CH3-(C=O)--O-(O=C)-C6H5 + H-Cl(g) ↑
Namensbegründung: Säureanhydrid plus Wasser ergibt die Säure. Essigsäureanhydrid reagiert mit Wasser irreversibel zur Essigsäure, CO2 + Wasser reagiert reversibel zu Kohlensäure, SO2 + Wasser zu Schwefligsäure, SO3 + H2O zu Schwefelsäure etc.
c) Diskutieren Sie, welcher Stoffgruppe dieser Stoff formal auch zugeordnet werden könnte.
Formell bzw. strukturell besitzen Carbonsäure-Anhydride Ähnlichkeiten mit den Estern von Alkoholen und Phenolen, Alkyl- und Phenylestern.
Bei den Alkylester befinden sich an der Carboxylatgruppierung, hier im Beispiel bei Essigsäureester die Acetatgruppierung jeweils ein Alkylrest, CH3-(C=O)-O-R, allgemeiner R´-(C=O)-O-R, mit R = Alkyl, zB. : CH3 , CH3-CH2-
Bei den Phenylester hingegen befinden sich dagegen an der Carboxylatgruppe Phenylreste, substituierte Phenylreste, Beispiele:
Essigsäure-phenylester: CH3-(C=O)-O-C6H5
Essigsäure-2-hydoxy-phenylester : CH3-(C=O)-O-[2-(OH)-C6H4]
Bei den Carbonsäure-Anhydriden befinden sich anstelle der Alkyl- oder Phenyl-Substituenten Acylreste, R-(C=O)-
CH3-(C=O)-O-(C=O)-R bzw. CH3-(C=O)-O-(O=C)-CH3 im Falle von Acetanhydrid, mit dem Acetylrest, -(O=C)-CH3
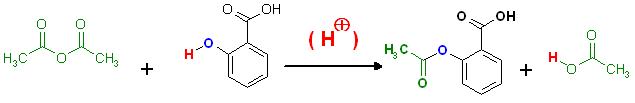
3) a) Stellen Sie die Reaktionsgleichung für die Synthese von Acetylsalicylsäure in Strukturformeln auf . Benennen Sie alle Reaktionsprodukte.
Darstellung eines Esters ausgehend von einem Carbonsäure-Anhydrid(Essigsäureanhydrid) und einem Alkohol(Phenol, Salicysäure als Phenol- , Alkoholkomponente)
Säurekatalysierte Alkoholyse(Phenolyse) von Acetanhydrid(Essigsäureanhydrid)
Katalysator: ( H (+) )
Skizze
c)Erläutern ie warum bei der Synthese darauf geachtet werden muß, daß sich kein Wasser im Kolben befindet.
Unerwünschte Verseifung der Acetylsalicylsäure mit Wasser unter Säurekatalyse zur Salicylsäure(Phenol-Komponente, Alkohol) und Carbonsäure, Essigsäure
Die Veresterung von Acetanhydrid mit Salicylsäure als Alkoholkomponente findet hier unter Säurekatalyse statt.
Nun lassen sich Ester auch unter Säurekatalyse mit Wasser verseifen zur Carbonsäure und Alkohol.
Diese unerwünschte Reaktion, die das gewünschte Produkt zerstört, soll verhindert werden.
Skizze
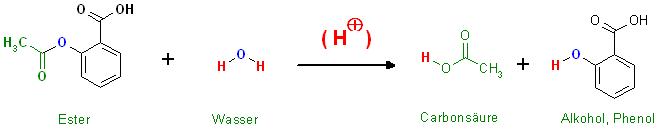
Säurekatalysierte Verseifung von Acetylsalicysäure, ( H(*) ) zu Essigsäure plus Salicylsäure
4)a)Stellen Sie den Reaktionsmechanismus für die Synthese des Wintergrünöls auf und benennen Sie diesen.
Wintergrünöl : Salicylsäure-methylester, [2-(OH)-C6H4 ]-(C=O)-O-CH3
Skizze zu "Wintergrünöl"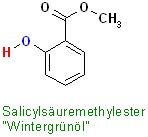
Text erkannt:
Salicylsäuremethylester "W/intergrünöl"
Edukte: Salicylsäure und Methanol, Katalysator: 90 - 98 %ige Schwefelsäure
Säurekatalysierte Versterung einer Carbonsäure, jetzt ist in diesem Beispiel die Salicylsäure die Carbonsäure-Komponente mit einem Alkanaol, Methanol zum entsprechenden Methylester
Reaktionsgleichung
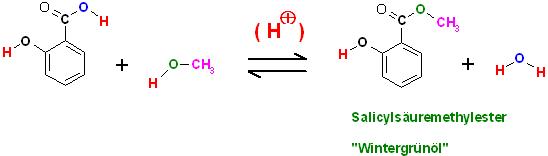
Text erkannt:
Salicylsäuremethylester
"Wintergrünöl"
Mechanismus
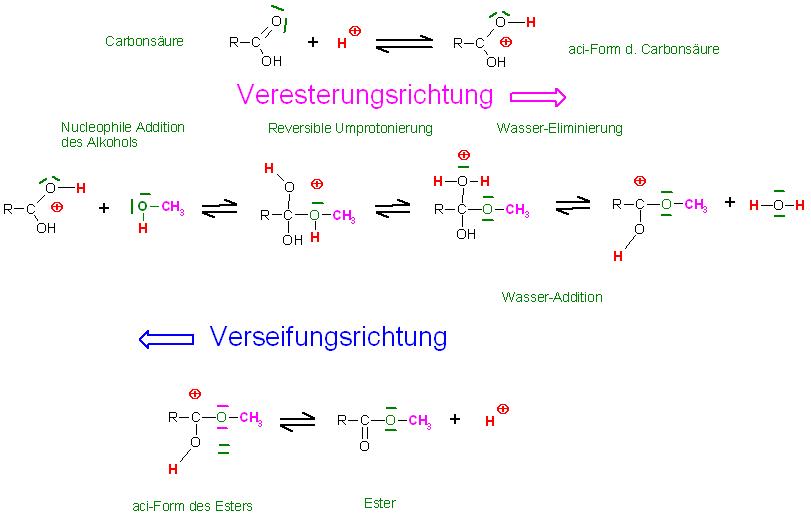
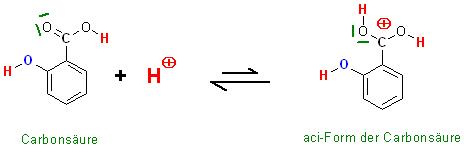
1. Schritt : Protonierung der Carbonsäure am Carboxylsauerstoffatom zur aci-Form der Carbonsäure, die Elektrophilie des Kohlenstoffatoms der Carboxylgruppe ist nun erhöht
Beim Versetzen der schwachen bis ggf. mittelstarken Carbonsäure mit der katalytisch kleinen Menge an starker Säure( 90 - 98 %ige Schwefelsäure) wird die Dissoziation der schwachen Carbonsäure zurückgedrängt, und ein sehr geringer Teil der undissoziierten Carbonsäure wird an den Sauerstoffatomen der Carboxylgruppe protoniert zur aci-Form der Carbonsäure.
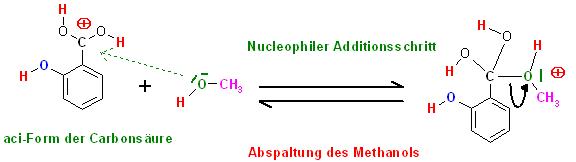
2. Schritt: Reversible, Nucleophile Addition des Alkohols(Methanol) mit dem freien Elektronenpaar am Kohlenstoffatom der protonierten Carboxylgruppe der Carbonsäure, Abspaltung des Alkohols als Umkehrreaktion(Gegenreaktion)
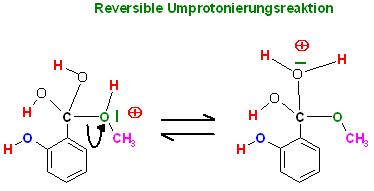
3.Schritt: Reversible Umprotonierung
Skizze
4. Schritt: Reversible Eliminierung des Wassers und die Addition des Wassers an der protonierten Carboxylgruppe des entstandenen, protonierten Esters, als Gegenreaktion(Umkehrreaktion)
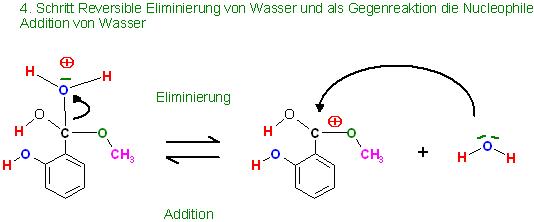
5. Reversible Deprotonierung der aci-Form des Esters(protonierter Ester) zum Ester
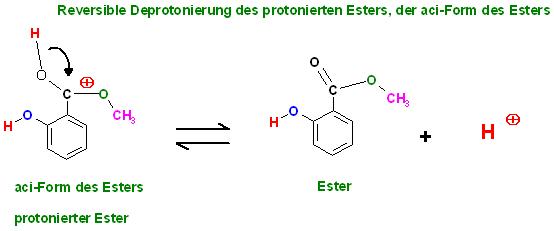
Skizze Veresterung-Verseifungsgleichgewicht unter Säurekatalyse, zusammenfassend