Hey racine,
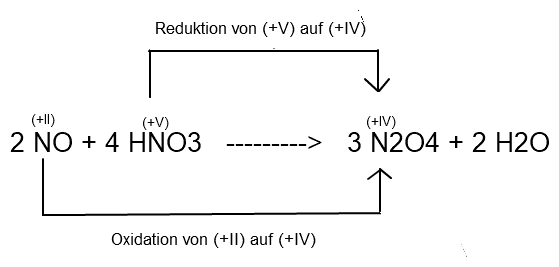
muss ich es dann wie in dem Bild machen? (Aber in dem Bild gibt es irgendwie nur eine Reduktion, weil O bleibt ja überall bei der Oxidationszahl -II)
Aus deinem Bild werde ich nicht so ganz schlau, aber selbstverständlich muss es auch eine Oxidation geben:
Das wäre dann folgendermaßen:
Oxidation: NO → N2O4
(+II)(-II) (+IV)(-II)
Reduktion: HNO3 → N2O4
(+I)(+V)(-II) (+IV)(-II)
(Quelle: Eigene Grafik)
Ganz interessant, dass wir hier einen besonderen Fall einer Redoxreaktion haben.
Ich habe das irgendwie noch als Synproportionierung in Erinnerung, also zwei Atome des gleichen Elements, mit einer niedrigeren und höheren Oxidationsstufe, die ein Produkt mit einer dazwischenliegenden Oxidationszahl bilden.
Bei der Reduktion entsteht zwar als Nebenprodukt Wasser, was beim Ladungsausgleich zum Einsatz kommt, die Pfeile für die eigentliche Redoxreaktion stellen sich aber wie oben gezeichnet dar.
Viele Grüße :)