Aufgabe:
Olivenöl ist ein Gemisch aus Fettmolekülen. Fettmoleküle sind Verbindungen aus dem dreiwertigen Alkohol Glycerin und 3 Fettsäuren. (=langkettige Carbonsäuren). Fettsäuren sind aufgrund ihrer langen Kohlenwasserstoff-Reste hydrophob.
Der Stoff Glycerin C3H8O3 ist aber sehr gut wasserlöslich.
Wie bezeichnet man die vorherrschenden zwischen-molekularen Kräfte zwischen den Fettsäure-Molekülen?
Geben Sie an, welche zwischen-molekularen Kräfte zwischen Glycerin-Molekülen und Wassermolekülen vor allem wirksam werden.
Zeigen Sie diese Wechselwirkungen zwischen einem Glycerin-Molekül und Wassermolekül anhand von LEWIS-Formeln und geeigneten Hilfslinien.
Problem/Ansatz:
Die erste Frage habe ich mit: Van-der-Waals-Kräften beantwortet.
Die zweite Frage habe ich mit: Van-der-Waals-Kräfte, Dipol-Dipol-Kräfte und Wasserstoff-Brücken
Die dritte Frage ist diese Skizze hier:
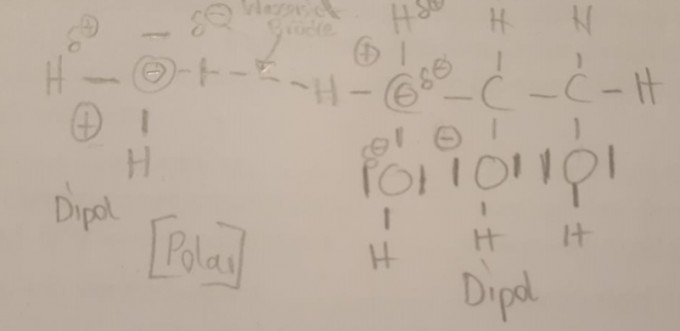
Stimmt das alles so? Ich habe leider keine Lösung von der Lehrerin bekommen.