Salut,
Zeichne ein Schalenmodell für:
1. Stickstoff-Ion
2. Aluminium-Ion
3. Kaliumatom
Kurze Erklärungen:
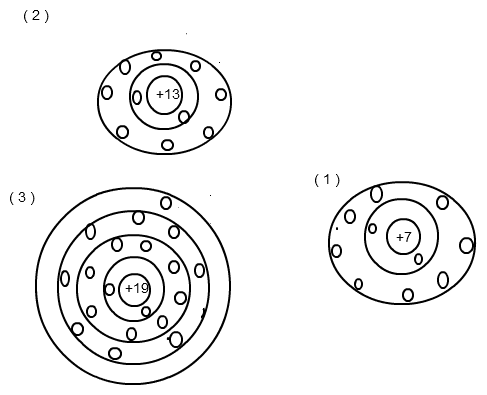
( 1 ) Stickstoff befindet sich in der V. Hauptgruppe und hat somit 5 Außenelektronen. Durch Aufnahme von 3 weiteren Elektronen entsteht das 3fach negativ geladene Stickstoff - Anion. (→ 7 Protonen, 10 Elektronen). Die Außenschale ist dadurch mit 8 Elektronen komplett gefüllt.
( 2 ) Aluminium steht in der III. Hauptgruppe, besitzt also 3 Valenzelektronen. Um eine stabile Edelgaskonfiguration zu erreichen, trennt es sich (wie andere Metalle auch) sehr leicht von seinen 3 Außenelektronen, erreicht dadurch eine vollständig gefüllte Außenschale und wird zum 3fach positiv geladenen Aluminium - Kation ( Al3+). (→ 13 Protonen, 10 Elektronen.)
( 3 ) Bei Kalium hast du es nun nicht mehr mit einem Ion, sondern mit einem nach außen elektrisch neutralen Atom zu tun. Das heißt, die Protonenzahl (19) ist gleich der Elektronenzahl (19). Allerdings musst du hier aufpassen mit der Besetzung der Schalen. Die innere K - Schale ist mit 2 Elektronen voll besetzt, die L - Schale mit 8 Elektronen ebenfalls. Die M - Schale enthält hingegen nur 8 Elektronen, ist also noch nicht voll gefüllt, die N - Schale besitzt aber bereits 1 Elektron. Diesen Umstand kann man nun dadurch erklären, dass die 4s Orbitale energetisch günstiger sind als die 3p Orbitale und deshalb zuerst belegt werden. Ich vermute aber fast, dass ihr das noch nicht behandelt habt und eher dahingehend begründet, dass Kalium als Element der I. Hauptgruppe und 4. Periode eben 4 Schalen aufweist und lediglich über ein einziges Außenelektron verfügt.
Bitte demnächst aber nur eine Aufgabe pro Frage !
Bonne nuit :)