Salut Selina,
Ist CF4 ein polares Molekül oder nicht?
Fluor: EN 4
Kohlenstoff: EN 2,5
⇒ Elektronegativitätsdifferenz ΔEN = 1,5
Obwohl sich dadurch CF4 als Molekül mit polaren Atombindungen präsentiert, weist es nach außen kein Dipolmoment auf. Der Grund liegt in seinem symmetrischen Aufbau, denn durch die tetraedrische Geometrie fallen die Ladungsschwerpunkte zusammen und heben sich auf.
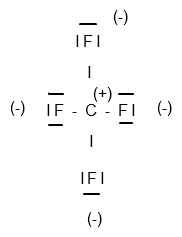
(Quelle: Eigene Grafik)
( Anmerkung: Statt (-) und (+) müsste korrekterweise mit δ- und δ+ beschriftet werden, was mir aber aber mit dem Zeichentool rein technisch nicht möglich ist. )
In jedem Fall erkennst du an der Zeichnung, dass das einzig vorhandene Kohlenstoffatom im Zentrum die positive Partialladung trägt, sich also dort auch der positive Ladungsschwerpunkt befindet. Da nun der Ladungsschwerpunkt der vier negativen Partialladungen der Fluoratome aber ebenfalls im Zentrum anzutreffen ist, fallen positiver und negativer Ladungsschwerpunkt zusammen und heben sich auf. Somit stellt CF4 auch keinen Dipol dar.
Schöne Grüße :)
