Hi, here chemweazle,
Für die Grenzformeln des Stickstoffdioxides, ein ungerades Molekül, Molekülradikal mit ungerader Elektronenzahl, engl. odd molecule.
Die erste Grenzformel ist fehlerhaft. Dort kommt man auf eine Gesamtformalladungszahl von (-2).
Die zweite ist perfekt, Ok.
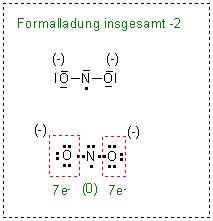
Habe noch eine kleine Alternative, erzeugt aus der zweiten durch Vertauschung des Elektronenpunktes vom ungepaartem Elektron mit einem Elektronenpaarstrich vom Sauerstoffatom links in der Skizze.

Grüße chemweazle