Hi, hier chemweazle,
Zu
Hey Leute, ich habe ein ''Online-Labor'' bekommen. Darin sind Protokollvorlage und Messergebnisse. Bei einem habe ich ein Problem. Ich habe Werte für einen Spektralphotometrischen Versuch bekommen. Dazu die Absorptionswerte von verschiedenen Proben Zusammensetzungen von Kupferlösungen ( 60,70,80,90 & 100mg auf 100ml) zu den Wellenlängen von 400-700nm. Das Protokoll sieht nun so aus:
Was meint man mit dem Wort Absorbtionswerte?
Ist hier die damit die Extinktion, auch Absorbanz, engl. absorbance, genannt, gemeint?
Die Bouger-Lambert-Beer`sche Beziehung
$$E = log_{10}\left[\frac{I_{0}}{I}\right] = \varepsilon(\lambda)\cdot c\cdot d$$
Nun fehlt wohl der von der Wellenlänge abhängige Extinktionskoeffizient: ε(λ).
Man braucht ihn vielleicht auch für die Auswertung der Analyse nicht.
Sicherlich sind die Extinktionswerte und die zugehörigen Massenkonzentrationen von Kupfer(II), cm(Cu2 +), als Wertepaare gegeben.
Der Extinktionskoeffizient steckt als Faktor in der Steigung der Calibriergeraden.
Der Extinktionskoeffizient, die Schichtdicke der Küvetten und auch der Kehrwert der Molmasse von Kupfer stecken in der Steigung der Kalibriergeraden drin.
Die Kalibriergrade geht auch durch den Nullpunkt, Ursprung; des Koordinatensystems. Denn bei der Kupferkonzentration von Null ist auch die Extinktion gleich Null, bzw. die Transmission gleich 1 oder 100%.
Also aus den Wertepaaren die Steigung a mittels der Linearen Regression berechnen. Dann den Extinktionswert der Analysenprobe durch die Steigung a dividieren und als Ergebnis den Kupfergehalt in der Analysenlösung erhalten.
Extinktionswert der Analysenprobe: E(Analyse)
$$cm(Cu) = \frac{E(Analyse)}{a}$$
Da nicht mit der molaren Konzentration von Kupfer, sondern mit der Massenkonzentration cm(Cu2+) gearbeitet wird, steckt in der Steigung auch der Kehrwert der Molmasse von Kupfer drin.
$$E = \varepsilon\cdot d\cdot c(Cu^{2+}) = \varepsilon\cdot d\cdot \frac{1}{M(Cu)}\cdot cm(Cu^{2+})$$
E = a * cm(Cu2+)
Skizze
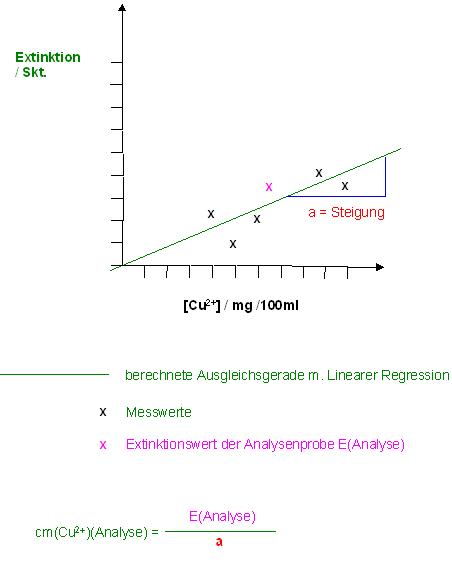
Zur Bestimmung des Extinktionskoeffizienten ε(λ) müßte nur noch die Steigung a durch die Küvettendicke, der Duchgangsweg des Lichtes durch die Küvette, dividiert werden und mit der Molmasse von Kupfer multipliziert werden.
Anschließend den erhaltenen Extinktionskoeffizient mit den tabellierten Werten vergleichen und die zugehörige Wellenlänge zuordnen.