Gruß chemweazle,
Zu
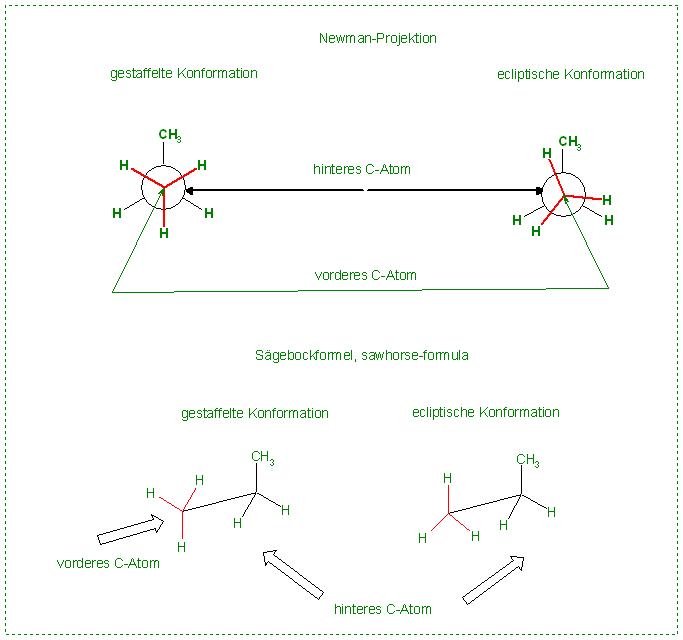
Charakteristische Newman-Projektionen zeichnen
Zeichnen Sie je zwei charakteristische Newman-Projektionen von 1,2-Dichlorheptan und Propan.
Die Methylgruppen, CH3-, Methylengruppen, CH2-, CH-Cl-Gruppen, CHOH-Gruppen bei den Zuckern etc. können um die Einfachbindung, die die Rotationsachse ist, wie Schiffschrauben oder Propeller frei drehen.
Die Drehungen um die Einfachbindung(Rotationsachse) erfolgt durch Stöße zwischen den Molekülen.
Das passiert in der Schmelze oder in Lösung. Hierbei stoßen die Moleküle untereinander oder die gelösten Moleküle mit den Lösungsmittelmolekülen zusammen.
Es ergeben sich verschiedene Winkeleinstellungen der rotierenden C-H- bzw. C-Chlorgruppen und C-CH3-Bindungen untereinander.
Fast jeder „Rotor“ macht im Laufe der Zeit eine volle 360 Grad – Drehung, wenn es keine allzustarke räumliche Hinderung(sterische Hinderung) gibt. Die Drehungen können sowohl in die eine oder anderen Drehrichtungen erfolgen.
Jede Winkeleinstellung, auch Konformation genannt, ist im flüssigen Aggregatzustand der Substanzen nur vorübergehend.
Im Kristallgitter(Feststoff) hingegen, sind diese Konformationen(Winkeleinstellungen) fest gegeben und ändern sich nicht. Erst beim Schmelzen der Substanz können die Moleküle zusammenstoßen, und ihre Gruppen dadurch frei, wie Propeller, um die Einfachbindungen rotieren.
Es gibt 2 extreme Winkeleinstellungen(Konformationen.
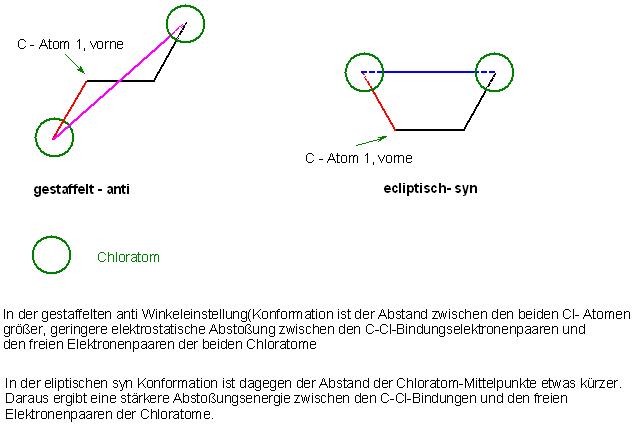
Es ist einerseits die "gestaffelte Konformation", wo die Bindungen der beiden Gruppen auf Lücke im ca. 60 Grad-Winkel zueinander stehen.
Dann das andere Extrem, die "ecliptische“ Konformation, bei der die Bindungen der Gruppen auf Deckung stehen.
Der Konformationswinkel ist hierbei Null Grad ( 0° ).
Beispiel am n-Propan
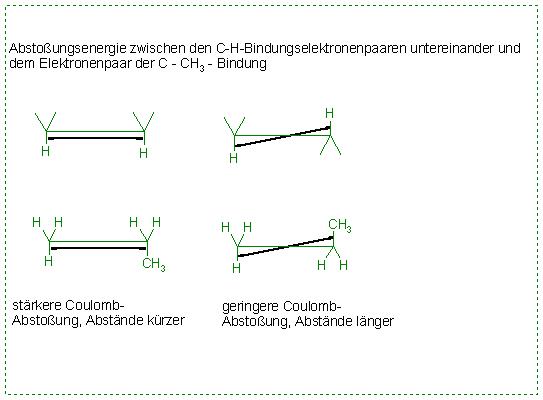
Bei der ecliptischen Konformation sind die C-H- und die C-CH3-Bindungen parallel.
Zwischen den Gruppen herrschen elektrostatische Abstoßunskräfte bzw. Abstoßungsenergien. Diese rühren von den Elektronenpaaren der C-H-Bindungen und dem Elektronenpaar der C-CH3-Bindung her.
Bei der ecliptischen Konformation sind, da die Bindungen parallel sind, die Abstände der Bindungen der einzelnen Gruppen kürzer, als es bei der gestaffelten Konformation ist.
Deshalb ist die elektrostatische Abstoßungenergie bei der ecliptischen Form größer, als bei der gestaffelten Form.
Die ecliptische Form ist somit energiereicher, als die gestaffelte Konformation.
Skizze
1,2-Dichloralkane, hier im Beispiel das 1,2-Dichlorheptan
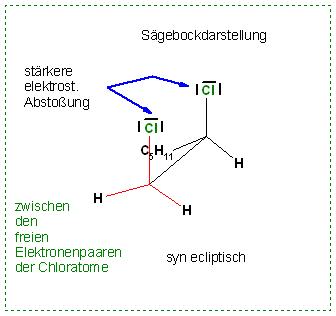
Hier treten elektrostatische Abstoßungen zwischen den C-Cl-Bindungselektronenpaaren und zwischen den freien Elektronenpaaren der beiden Chloratome auf.
Die beiden extremen Konformere sind:
a). Das energiereichste Konformer, das syn- ecliptische
b). Das energieärmste Konformer, das anti- gestaffelte
Das sind die wichtigeren für die Aufgabenstellung.
Anmerkung:
syn bedeutet: beide Substituenten, hier die Cl-Atome, oberhalb
anti bedeutet: einer der Substituenten(Cl-Atome) oberhalb, der andere unterhalb
Skizze: 1,2-Dichlorheptan, syn-ecliptisch in der Newman-Projektion
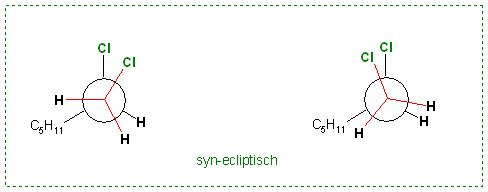
Skizze: 1,2 Dichlorheptan, syn-ecliptisch in der Sägebock-Formel, sawhorse-formula
Skizze: 1,2 Dichlorethan, anti-gestaffelt
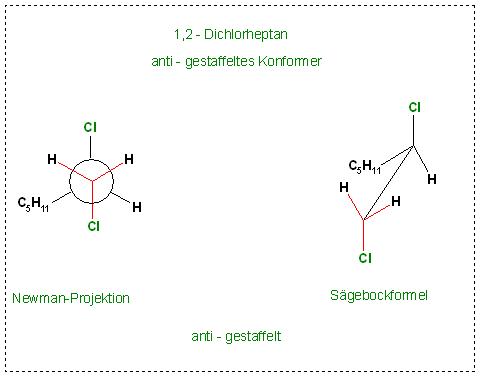
Bei der anti-gestaffelten Konformation ist der Abstand der beiden Chloratome größer, als es bei der syn-ecliptischen Konformation der Fall ist.
Die syn-ecliptische Form ist die energiereichste Form.
Die antigestaffelte Form ist die energieärmste von allen Konformationen.
Skizze

Skizze
:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
Für die Aufgabe sicherlich nicht notwendig:
Daneben gibt es die noch eine energiereiche syn-gestaffelte Konformation mit dem Spitznamen „gauche-Form“.
Skizze: 1,2-Dichlorheptan, syn-gestaffelt
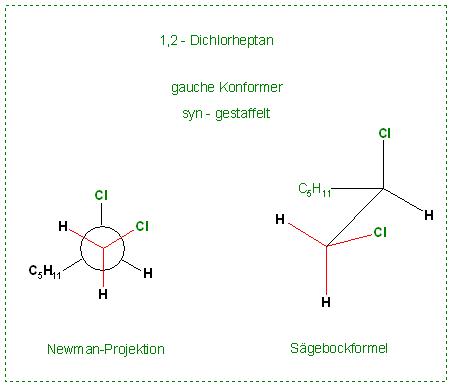
Nicht für die Aufgabe notwendig
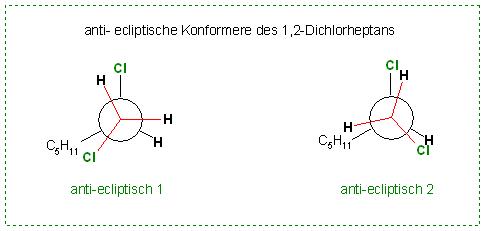
Man kann noch 2 anti-ecliptische Extremformen betrachten, wobei der 1ten in der Skizze eine sterische Hinderung zwischen dem Chloratom am 2ten Kohlenstoff und dem Pentylrest auftritt.
Skizze: 1,2-Dichlorheptan, anti-ecliptische Extremformen