Gruß chemweazle,
Lewis-Formeln folgender moleküle und Anionen
BF3, IPF3, NO2, H2S, XeF4, ISO3(2-), PCl6(-), ICl4(-)
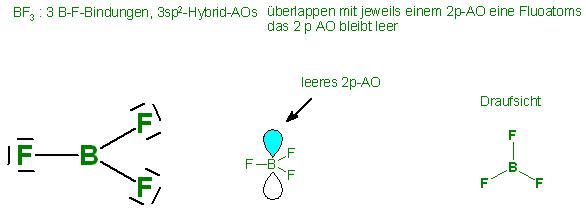
Skizze BF3, trigonal planar mit Elektronenpaarlücke
Skizze zum PF3, pyramidal, pseudo-tetraedrisch mit freiem Elektronenpaar

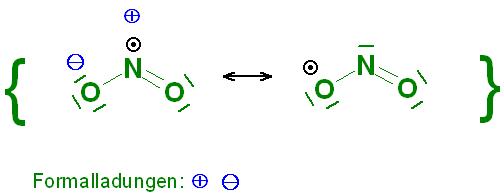
Skizze zum NO2, gewinkelt, ungepaartem Elektron(Radikal)
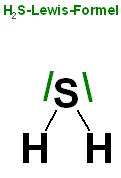
Skizze zum H2S, gewinkelt
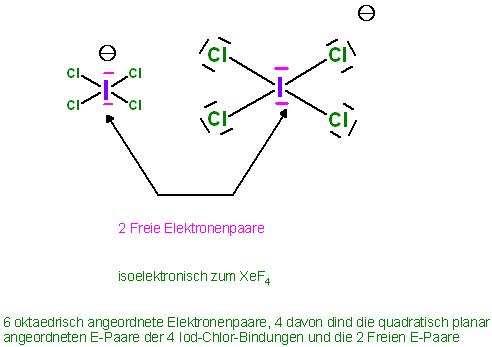
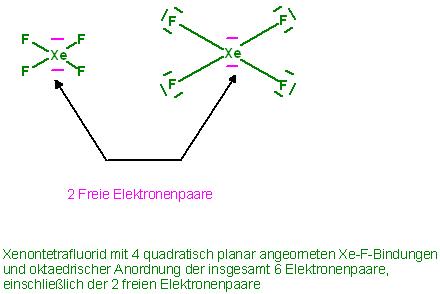
Skizze zum XeF4
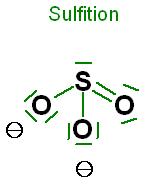
Skizze zum Sulfition, ISO3(2-), pyramidal
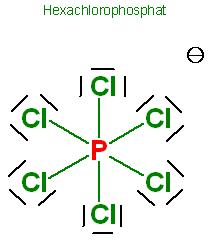
Skizze zum Hexachlorophosphat(V)-Ion, PCl6(-), oktaedrisch
Skizze zum Tetrachloroiodat(III)-Ion, ICl4(-), quadratisch planar, isoelektronisch zum XeF4