Gruß chemweazle,
Einfluß des positiven Induktiven Effektes(+ I-Effekt) im Zusammenhang mit den Additionsreaktionen an Alkenen(Olefinen)
Am Beispiel der in polaren Lösungsmitteln durchgeführten Halogenwasserstoffadditionen oder die säurekatalysierte Wasseraddition an C-C-Doppelbindungen mit Carbeniumionen als Zwischenprodukte
• Reaktion und Mechanismus am Beispiel mit Ethen zu Halogenalkan durch HX-Addition
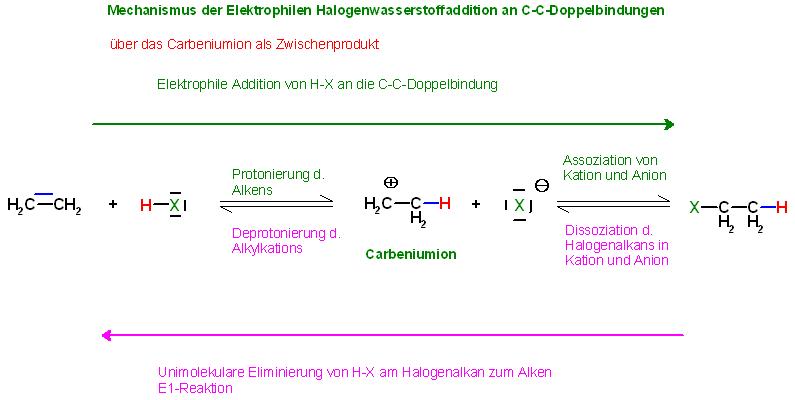
Mechanismus, Verlauf der HX-Addition an Alkene Die Protonierung von Alkenen und Alkinen zu Carbeniumionen ist eine reversible Reaktion.
• 1. Teilreaktion, reversibel
Die Hinreaktion ist die Protonierung des Alkens zu den Carbeniumionen, die Umkehrreaktion(Rückreaktion) ist die Deprotonierung zum Olefin oder Alkin.
Das Gegenion zum entstandenen Carbeniumion ist das Halogenidion, das Anion, X(-).
• Folgereaktion, meist reversibel Die Addition des Halogenidions, Anions an das Carbeniumion
Als reversible Folgereaktion findet die Assoziation von Carbeniumionen und Anionen, (Halogenidionen, X(-) statt. Die Umkehrreaktion zur Assoziation der Carbeniumionen mit den Halogenidionen ist die Dissoziation der Halogenalkanmoleküle in Carbeniumionen und Halogenidionen.
Betrachtet man alle Umkehrreaktionsschritte ausgehend von den Produkten, der Halogenalkane, so hat man den Reaktionsmechanismus der Unimolekularen Eliminierung, abgk. mit E1-Reaktion vor sich.
Skizze
Bei der Protonierung der Elektronenpaare von C-C-Doppelbindungen, auch Dreifachbindungen, reißt die Doppelbindung auf. Das Elektronenpaar ist nach der Protonierung das Elektronenpaar einer C-H-Bindung.
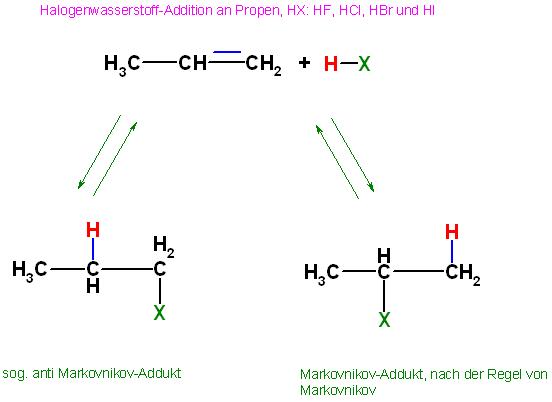
Es gibt bei den substituierten Alkenen, z.B. Propen(CH3-CH=CH2) 2 Möglichkeiten wie das durch die Protonierung neu entstandene C-H-Bindungselektronenpaar "hinklappt", nach links oder nach rechts in der Strukturformel.
Es sind 2 Produkte ( Halogenalkane ) ausgehend von Propen und Halogenwasserstoff denkbar, es sind:
Das Hauptprodukt
2 Chlorpropan(Isopropylchlorid), das nach der Regel von Markovnikov entsteht
Das Nebenprodukt
1 Chlorpropan, das sogenannte "anti Markovnikov- Produkt" in geringen Umfang
Die Markovnikov-Regel
Bei Alkenen mit + I-Substituenten, an der C-C-Doppelbindung addiert sich der Halogenwasserstoff, HX, mit dem Wasserstoffatom an das wasserstoffreichere C-Atom und das Halogenatom, X, an das C-Atom, welches weniger H-Atome besitzt.
Das wasserstoffreichere C-Atom der C-C-Doppelbindung ist beim Propen (CH3-CH=CH2 ) die =CH2-Gruppierung, dorthin addiert sich bevorzugt das H-Atom des HX-Moleküls.
+ I- Substituenten, R, am Vinylrest, ( C=C ), des Alkens lenken durch den Elektronenschub die Addition von Halogenwassestoff oder Wasser entsprechend der Markovnikov-Regel.
| R-CH=CH2 | + | H-X | ⇌ | R-CH(X)-CH2-(H) | und | R-CH(H)-CH2-(X) |
| | | | Markovnikov-Addukt, Hauptprodukt | | Nebenprodukt in kleiner Menge |
Skizze HX-Addition an Propen Gesamreaktion
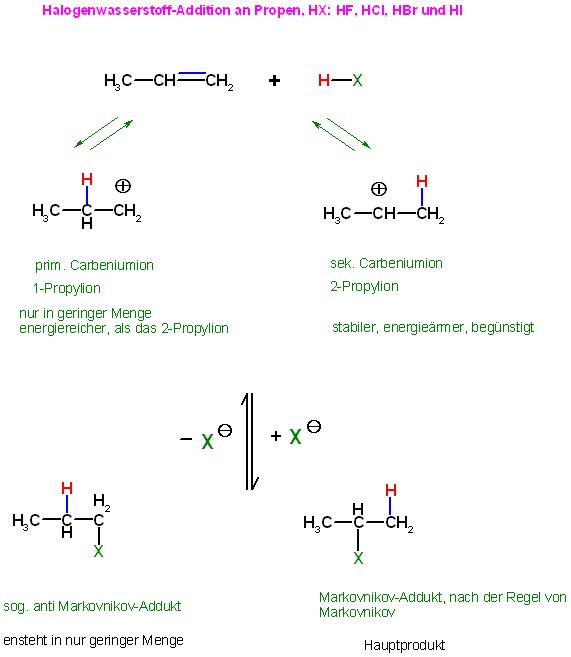
Beim Ethen spielt das keine Rolle, dort kann nur die 1 Sorte von Carbeniumion entstehen, das Ethylkation.
Beim Propen entstehen 2 denkbare Carbeniumionen, Propylkationen.
.
Das prim. Propylkation, Prop-1-yl-Kation, und das sek. Propylion, Prop-2-yl-Kation .
| ⊕CH2-CH2-CH3 | | CH3-⊕CH-CH3 |
| prim. Carbeniumion, Prop-1-yl-Kation | | sek. Propylion, Prop-2-yl-Kation |
Skizze Mechanismus der HX-Addition an Propen bzw. Die HX-Eliminierung an den Halogenalkanen
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
Einschub
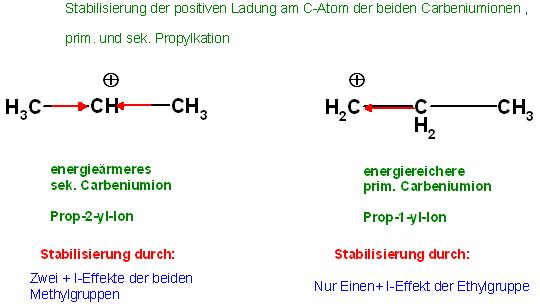
• Die Energiearmut(sog. Stabilität), der Carbeniumionen im Vergleich Unter Energie wird die Gesamtenergie, Summe aus potentieller und kinetischer Energie, aller Elektronen im jeweilig betrachteten Carbeniumion verstanden.
Das sog. "Stabilere Carbeniumion", so heißt es im Jargon, ist das mit der geringeren Gesamtenergie der Elektronen(Elektronische Gesamtenergie).
Das energieärmere, im Jargon stabilere, Carbeniumion ist das, bei welchem das postiv geladene C-Atom durch die benachbarten Alkylsubstituenten Elektronenschub entlang der C-C-Bindungungen erhält. (+ I-Effekt )
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
a). Das energieärmere 2- Propylkation
Das Prop-2-yl-Kation ist durch den +I-Effekt der beiden Methylgruppen, CH3-Gruppen, etwas energieärmer, als das prim. Carbeniumion, Prop-1-yl-Kation.
b). Das energiereichere 1- Propylkation
Das positiv geladene C-Atom beim Prop-1-yl-Kation erfährt nur einen Elektronenschub von der benachbarten CH2-Gruppe oder vom gesamten Ethylrest, -CH2-CH3.
Beim sek.Propylion erfährt das positiv geladene C-Atom fast den doppelten +I-Effekt von den 2 benachbarten Methylgruppen.
Die + I-Effekte an beiden Carbeniumionen
prim. Carbeniumion, energiereicher, nur 1 Stabilisierung der pos. Ladung durch einen + I-Effekt des benachbarten Ethylrestes(←CH2-CH3)
⊕CH2←CH2-CH3
sek. Carbeniumion, energieärmer, stabiler, als das prim. Carbeniumion
CH3→⊕CH←CH3
Skizze