Salut Hannah,
Warum haben Ethanol und Metahnol ähnlich aber letztlich verschieden große siedetemperaturen?
Dazu schau dir die jeweilige Strukturformel einmal an:
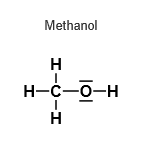
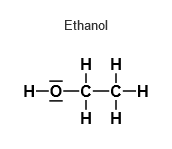
Der Siedepunkt ist nun abhängig von den Wechselwirkungskräften der Teilchen und umso höher, je größer diese Kräfte sind. Methanol und Ethanol haben beide jeweils eine polare OH - Gruppe und können untereinander Wasserstoffbrückenbindungen bilden. Die Kräfte sind jedoch vergleichbar groß und erklären somit noch nicht die höhere Siedetemperatur von Ethanol.
Ausschlaggebend sind letztlich die unpolaren Alkylreste. Ethanol hat einen längeren Alkylrest als Methanol, was dazu führt, dass stärkere Van - der - Waals - Kräfte herrschen und damit ein stärkerer Zusammenhalt der Moleküle gegeben ist, der erst überwunden werden muss, will man die Moleküle in die Gasphase überführen. Je länger also die Kettenlänge ist bzw. je mehr Kohlenstoffatome in einem Molekül miteinander verbunden sind, desto höher ist der Siedepunkt.
°°°°°°°°°°
Schöne Grüße :)