Grüße chemweazle,
Welchen Titer hat eine Natriumthiosulfatlösung mit der ännähernde Stoffmengenkonzentration c(Na2S2O3) = 0,1 mol / L von der 39,6 ml erforderlich sind , um 0,4941 g Iod zu reduzieren?
Problem/Ansatz: … wie musste man rechnen?
Reaktionsgleichung
2 (-)O3S-S(-) + I2 → (-)O3-S-S-SO3(-) + 2 I (-)
Mechanismus
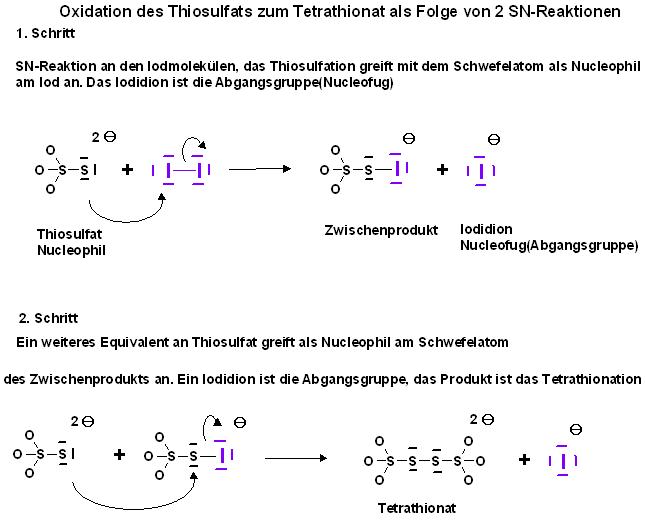
Stöchiometrische Verhältnisse von Thiosulfat zu reduzierten, verbrauchten Stoffmenge an Iod
2 mol Thiosulfat reagieren mit 1 mol Iod unter oxidativer Kupplung zu 1 mol Tetrathionat.
Die Stoffmenge an verbrauchten Thiosulfat ist doppelt so groß, wie die Stoffmenge an verbrauchtem Iod.
Das Stoffmengenverhältnis von verbrauchtem Thiosulfat zur Stoffmenge an verbrauchtem Iod ist 2 : 1 und entspricht dem Verhältnis der stöchiometrischen Koeffizienten in der Reaktionsgleichung.
$$\frac{n(S_{2}O_{3}^{2-})}{n(I_{2})} = \frac{2}{1} = 2$$
n(S2O32-) = 2 * n(I2)
M(I) = 126,9045 g / mol und M(I2) = 253,809 g / mol
$$n(I_{2}) = \dfrac{m(I_{2})}{M(I_{2})} = \frac{0,4941\cdot g\cdot mol}{253,809\cdot g} \approx 0,00195 mol$$
n(S2O32-) = 2 * 0,00195 mol = 0,0039 mol = 3,9 mmol
V(S2O32-) = 39,6 ml
$$c(S_{2}O_{3}^{2-}) = \dfrac{n(S_{2}O_{3}^{2-})}{V(S_{2}O_{3}^{2-})} = \frac{3,9\cdot mmol}{39,6\cdot ml}$$
Reale Konzentration der Thiosulfat-Maßlösung
c(S2O32-)(real) ≈ 0,0985 mmol / ml
Der Titer, t, das Verhältnis von der realen Konzentration, 0,0985 mol / l, zur gewünschten Konz. , 0,1 mol / l, lautet:
$$t = \frac{0,0985\cdot mol\cdot l}{0,1\cdot mol\cdot l} = 0,0985\cdot 10 = 0,985$$