Salut,
Warum kann die Verbindung SF6 existieren, aber OF6 nicht ?
Die Verbindung OF6 kann es nicht geben, da dem Sauerstoff als Element der 2. Periode keine d - Orbitale zur Ausbildung kovalenter Bindungen zur Verfügung stehen und somit die benötigte Bindigkeit nicht erreicht werden kann.
°°°°°°°°°°°
Im Gegensatz dazu sind aber d - Orbitale bei Elementen der 3. Periode ( → Schwefel) für Bindungen verfügbar.
Schau dir zunächst die Valenzelektronenkonfiguration des Schwefelatoms im Grundzustand an ...
S 3s ↑↓ 3p ↑↓ ↑ ↑ 3d - - - - -
und nun im Vergleich den angeregten Zustand, der für die Bindung vonnöten ist. (Die beiden Sterne verdeutlichen dabei die Anregung von 2 Elektronen.)
S** 3s ↑ 3p ↑ ↑ ↑ 3d ↑ ↑
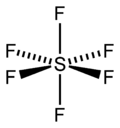
Das angeregte Schwefelatom weist demnach 6 ungepaarte Elektronen auf und kann somit 6 Atombindungen ausbilden.
Summa summarum erweist sich dadurch SF6 als existent:
°°°°°°°°°°°°°°°°°°°°°°°°