Salut Kristin,
hier die versprochene Antwort auf deine schöne Frage :)
Zunächst sollte man sich von dem Gedanken befreien, dass die Oktettregel immer und überall erfüllt sein muss. Es gibt genügend Fälle, wo mehr oder weniger der für die Edelgasregel benötigten Elektronen herumflitzen. Schaut man sich nun Verbindungen mit weniger als einem Valenzelektronen-Oktett an, so trifft man diesen Zustand hauptsächlich bei den Elementen der III. Hauptgruppe an, also beispielsweise bei Aluminium, Beryllium und natürlich auch bei Bor.
Betrachten wir jetzt mal das Bortrifluorid: Die Bindungen sind kovalenter Natur und man erhält 3 Fluoratome mit Oktett, mittig das Bor-Atom mit lediglich einem Elektronensextett, d.h. zwei Elektronen "fehlen" also noch.
Ein wenig fängt man an die Chemie von Bor zu begreifen, wenn man berücksichtigt, dass es sich bei BF3 um ein hoch reaktives Gas handelt, das immer auf Suche nach Elektronenpaaren ist, die es anziehen und vereinnahmen kann.
Im Klartext: Das Zentralatom Bor versucht sein Oktett dadurch zu vervollständigen, dass es sich ein einsames Elektronenpaar von einem zusätzlichen Bindungspartner beschafft. Wenn nun beide bindenden Elektronen von einem Partner herstammen, spricht man übrigens von einer koordinativen kovalenten Bindung.
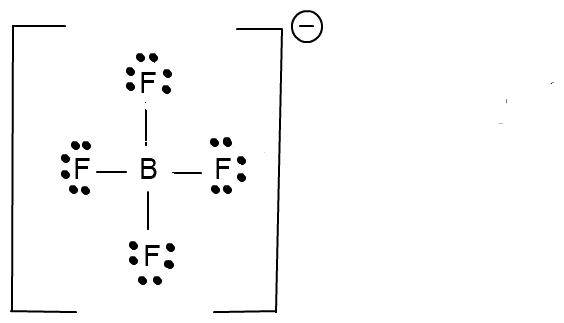
Daraus entstehen nun Kompositionen wie das bekannte BF4- und dies wohlgemerkt, obwohl Bor lediglich über 3 Bindungselektronen verfügt !
Als Gleichung sähe das folgendermaßen aus:
BF3(g) + F-(aq) → BF4- (aq)
Das Fluorid - Anion hat somit ein Elektronenpaar in die Bindung eingebracht.
(Quelle: Eigene Grafik)
In Wasser ist BF4- übrigens als HBF4 stabil.
Und damit soll es für den Anfang erstmal genug sein...
Danke übrigens, dass du diese spannende Thematik angesprochen hast. Meines Wissens nach war dies eine Premiere in der Chemielounge und dafür gibt es einen Pluspunkt !
Viele Grüße :)