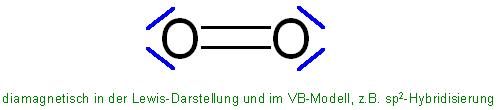
Grüße chemweazle,
Welche Elektronen gehören zur Doppelbindung und welche zu den freien Elektronenpaaren?
Es gibt gerade am Beispiel mit den MO-Schemata von Sauerstoff im Triplettzustand, das ist der Grundzustand und im elektronisch angeregten, durch Bestrahlung mit UV-Licht, Singulett-Sauerstoff so keine direkte 1:1-Zuordnung in die Lewis-Formel, was die " Freien Elektronenpaare " angeht.
MO-Schemata von Sauerstoff
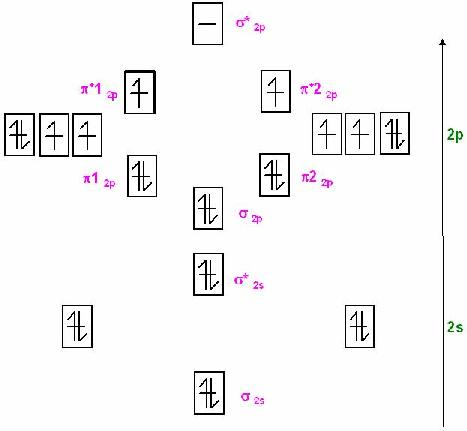
Skizze MO-Schema für dem Triplett-Sauerstoff im Grundzustand
Skizze MO-Schema für dem Singulett-Sauerstoff im photochem. angeregtem Zustand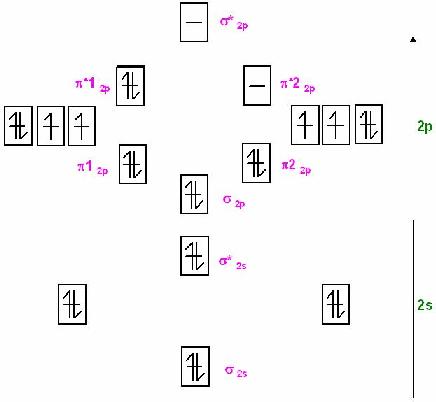
Bindungsordnung, BO:
Elektronen in bindenden MOs: 8
Elektronen in anti-bindenden MOs: 4
$$BO = \frac{1}{2}\cdot ( 8 – 4 ) = 2 \Rightarrow 1 Doppelbindung + 1 Einfachbindung$$
Triplett-Sauerstoff
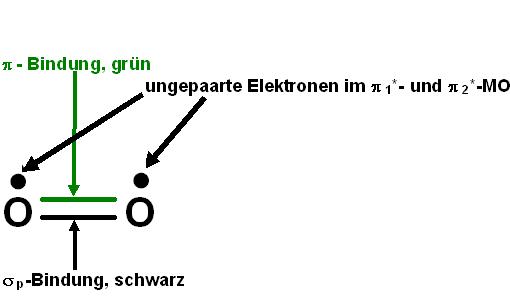
Die jeweils im Triplett-Sauerstoff halbbesetzten Antibindenden π*-MOs, π*12p1 und π*22p1 sind jeweils eine halbe Antibindung.
Beide halbe π-Antindungen ergeben in der Summe eine ganze Antibindung und heben eine der beiden π-Bindungen, π12p oder π22p auf.
Es verbleibt also nur 1 π-Bindung wirksam übrig.
Skizze
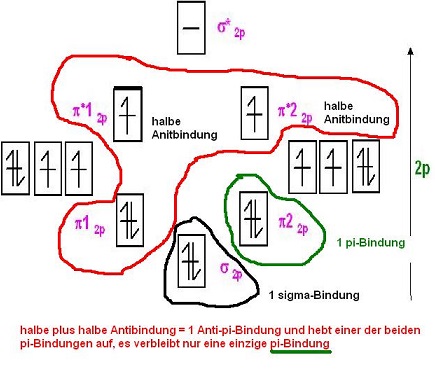 1 σ-Bindung + 1 π-Bindung + 2 ungepaarte Elektronen ür den aus dem MO-Schema für den Triplett-Sauerstoff hervor
1 σ-Bindung + 1 π-Bindung + 2 ungepaarte Elektronen ür den aus dem MO-Schema für den Triplett-Sauerstoff hervor
Skizze
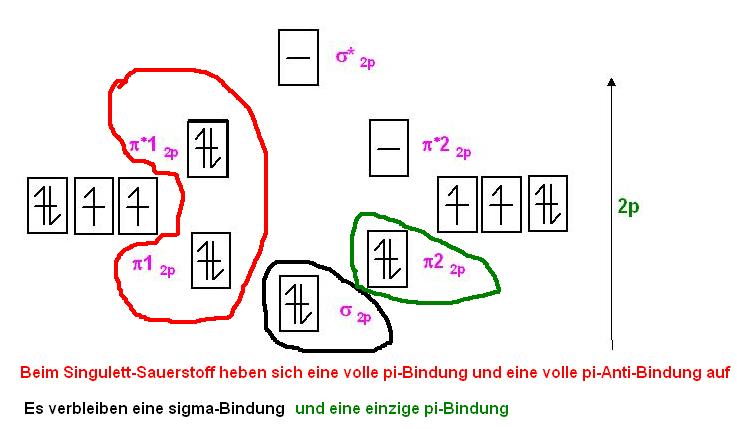
Singulett-SauerstoffIm Singulett-Sauerstoff ist eines der beiden antibindenden &pi* voll mit 2 Elektronen besetzt.
Es ist 1 ganze Antibindung und kompensiert somit eine der beiden π-Bindungen, so, daß nur noch 1 π-Bindung wirksam übrig bleibt.
Skizze

Text erkannt:
Beim Triplett-Sauerstoff liegen ungepaarte Eletronen vor, das erklärt sogar den experimentell gefundenen Paramagnetismus des Sauerstoffs.
Hingegen liefern die Lewis-Formel unter Einhaltung der Oktett-Regel und das VB-Modell mit der Hybridisierung, bei denen alle Elektronen gepaart vorliegen, den diamagnetischen Sauerstoff, der nicht ganz der Realität entspricht.
Skizze