Grüße chemweazle,
Zum Fragenkomplex
Warum gibt es kein BH3 monomer (Sondern) B2H6 jedoch monomers BCl3 in der Gasphase ?
Die Atome der Elemente der 3. Hauptgruppe, oder der Gruppe 13, sind in Verbindungen Elektronenmangelzentren. Mit anderen Worten sind diese Atome mit einer Elektronenpaar-Lücke Lewis-Säuren. Diesehätte gerne noch ein Elektronenpaar von irgeiner Lewis-Base zur Vervollständigung des Elektronen-Oktetts.
Es sind in Verbindungen die Elemente Bor, Aluminium, Gallium , Indium und ggf. noch Tl.
Ein Bor-Atom mit seinen 5 Gesamtelektronen hat insgesamt in der 2. Schale(Valenzschale) 3 Valenzelektronen.
Elektronenkonfiguration eines einzelnen Bor-Atoms : 1s2 2s2 2p1
Ein sp2-hybridisiertes Bor-Atom hat 3 sp2-AOs mit jeweils einem Elektron und ein leeres, unbesetztes 2p-Atom-Orbital.
Von einem Bor-Atom können nur 3 Einfachbindungen ausgehen.
Das Boratom hätte gerne 4 Elektronenpaare, Oktett , um sich herum.
Wie kann ein Boratom ein Elektronenoktett erreichen ?
Bor-Halogenide, warum monomer in der Gasphase
Bindungsverhältnisse in den BX3-Molekülen
Geht man im Hybridisierungs-Modell von einem sp2 hybridisierten Boratom aus, so kann das Boratom mit mit den 3 sp2-Orbitalen 3 Einfachbindungen zu 3 Halogen-Atomen eingehen.
Die 3 Einfachbindungen, σ-Bindungen, entstehen durch Überlappung der sp2-Orbitale des Boratoms mit den p-Atom-Orbitalen der Halogenatome. Es überlappt jeweils ein sp2-Atomorbital des Boratoms mit einem p-Atomorbital eines Halogenatoms.
Diese Einfachbindungen kann man sich etwas genauer aus der Überlappung jeweils eines sp2-Orbitals vom Bor-Atom mit dem 2p-Atom-Orbital eines Fluor-Atoms oder mit dem 3p-Atom-Orbital eines Chlor-Atoms oder 4p-Atom-Orbital eines Brom-Atoms entstanden denken.
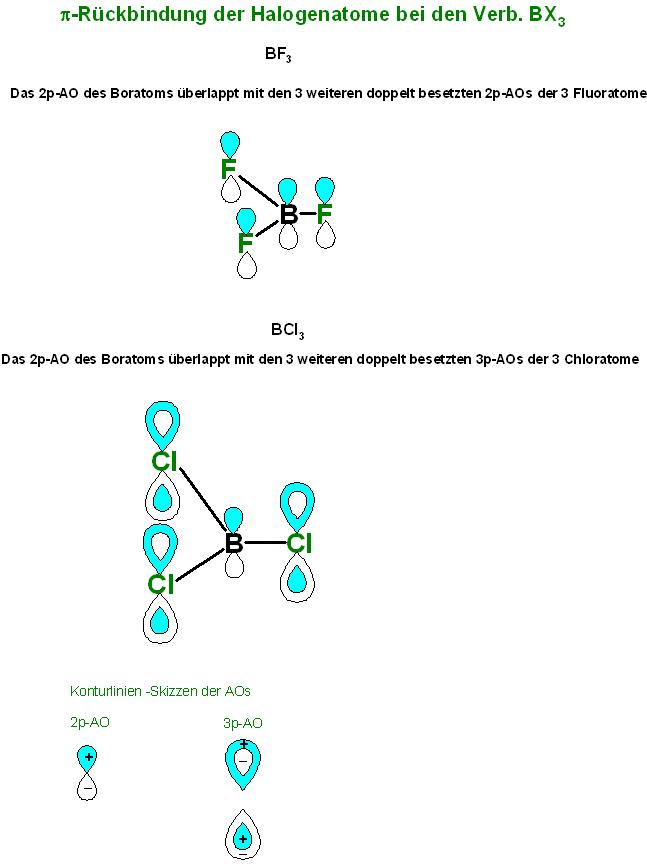
Die pi-Rückbindung der Halogenatome
Zusätzlich überlappt das leere p-Atom-Orbital des Bor-Atoms mit den p-Atom-Orbitalen der 3 Halogenatome., die senkrecht zur Bor-Halogen-Einfachbindung stehen.
Dabei erhöht sich die Elektronendichte am Boratom. Die Halogenatome leisten eine π-Rückbindung zum Bor-Atom.(Back-Donation)
Die Rückbindung (Backdonation) , die von den Halogen-Atomen geliefert wird, ist die Überlappung des vormals leeren, unbestzten 2p-AO des Bor-Atoms mit den np-Atom-Orbitalen der Halogenatome.
Skizze
Zum Boran, Borwasserstoff
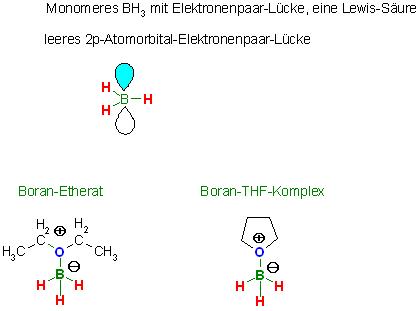
Mit 3 einzelnen Bor-Wasserstoff-Einfachbindungen in einem BH<sub>3</sub>-Molekül läßt sich kein Oktett erreichen.
In Lösungsmitteln , die noch über freie Elektronenpaare verfügen und als Lewis-Basen wirken , kann es zur Bildung von Addukten kommen.
Beispiele: Das BH3-Etherat, BH3–OEt2 oder Der Boran-THF-Komplex
Skizze
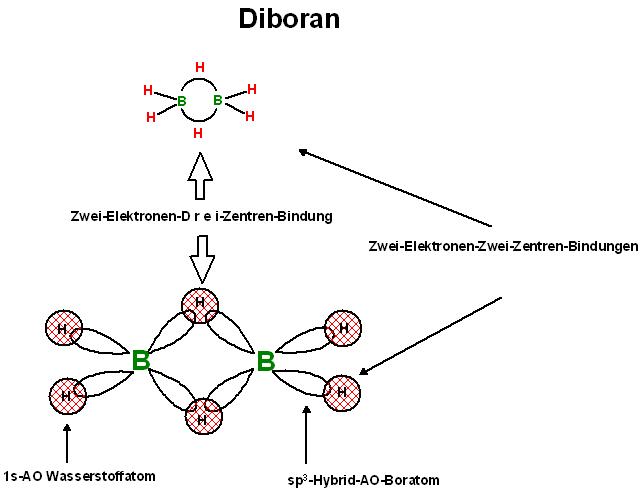
Das Modell der 2-Elektronen-3-Zentren-Bindung Das Diboran besitzt 2 BH2-Gruppen mit einerseits jeweils 2 endständigen B-H-Bindungen und 2 verbrückende Bor-Wasserstoff-Bor-Bindungen, diese sind Zwei-Elektronen-Dreizentren-Bindungen.
Die enständigen, nicht verbrückenden B-H-Bindungen sind im Gegensatz zu den verbrüchenden Bor-Wasserstoff-Bor-Bindungen gewöhnliche Zwei-Elektronen-Zwei-Zentren-Bindungen, also gewöhnliche B-H-Elektronenpaar-Bindungen.
Hybridisierungsmodell : Jedes der beiden Bor-Atome sei sp3-hybridisiert. Von jedem Bor-Atom gehen 2 endständige B-H-Bindungen aus , die nicht verbrückend sind, das sind die 2 Elektronen-Zwei-Zentren-Bindungen.
Die nicht verbrückenden B-H-Einfach-Bindungen kommen durch jeweils der Überlappung eines Bor-sp3-Hybrid-Orbitals mit einem 1s-Atom-Orbital des jeweiligen Wasserstoffatoms zustande.
Die beiden Molekül-Orbitale der verbrückenden Zwei-Elektronen-Drei-Zentren-Bindungen, Bor-Wasserstoff-Bor-Bindungen, kann man sich durch Überlappung eines 1s-Atom-Orbitals des jeweiligen Wasserstoffatoms mit dem sp3-Hybrid-Orbital des Bor-Atoms Nr.1 und dem sp3-Hybrid-Orbital des Bor-Atoms Nr.2 entstanden vorstellen.
Das MO einer Zwei-Elektronen-Dreizentren-Bindung wird durch Interferenz von 3 AO gebildet.
Skizze