Grüße chemweazle,
bin wieder genesen, war am Wochenende nicht mehr einsatzfähig.
Diese Frage besteht eigentlich aus 2 Teilen. Im 1. Teil geht es um die Komplexbildung allgemein aus der Sicht nach Lewis und der 2. Teil ist die Frage was sind Chelat-Komplexe.
Lewis-Säuren (Elektrophile), diese können elektrisch positiv geladen oder auch elektrisch neutral sen, sind Elektronenpaar-Acceptoren. Lewis-Basen sind Elektronenpaar-Donoren, Elektronenpaar-Geber, diese können elektrisch negativ geladen oder elektrisch neutral sein.
⇒Assoziation, Addition von Lewis-Säure und Lewis-Base ⇒
A + | B ⇌ A– B
⇐Dissoziation, Heterolytische vom Lewis-Säure - Lewis-Base-Addukt ⇐
A = Lewis-Säure(Elektronenpaar-Acceptor) , | B(Lewis-Base, Elektronenpaar-Donor, Elektronenpaar der rote Strich)
Verbindungen 1. Ordnung
Es gibt Verbindungen 1. Ordnung , wobei die Elemente in der Regel jeweils die Edelgas-Elektronen-Konfiguration erreicht haben.
Beispiel : Das wasserfrei Calciumchlorid
Das wasserfreie Calciumchlorid besteht aus im Kristallgitter aus Calcium(II)-Kationen und Chloridionen.
Die Calcium(II)ionen haben jeweils 18 Elektronen und haben somit die Elektronen-Konfiguration des vorangegangenen Edelgases Argon, [Ar] in der 3. Periode.
Ebenso haben die Chloridionen 18 Elektronen wie das darauffolgende Edelgas Argon, [Ar].
Verbindungen höherer. Ordnung, Koordinationsverbindungen
Reagieren Verbindungen 1. Ordnung unter Ausbildung zusätzlicher Elektronenpaar-Bindungen, so wird pro gebildete Bindung unter den gegebenen Reaktionsbedingungen Energie frei.
Calciumchlorid wasserfrei ist stark hygroskopisch und nimmt Wasser aus der Luft unter spürbarer Wärmefreisetzung auf.(Trockenmittel für Gase)
Dabei verändert sich die Kristallform.
Ebenso löst sich das wasserfreie Calciumchlorid unter starker Wärme-Entwicklung, exotherm in Wasser.
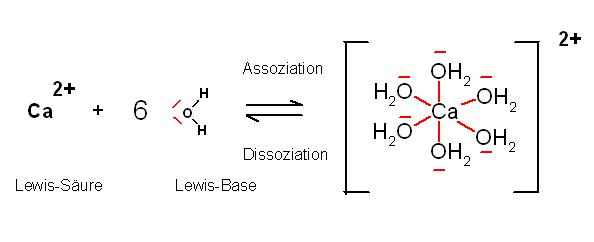
Dabei werden die Calcium(II)-Ionen jeweils mit 6 Wassermolekülen komplexiert.
Das Wassermolekül ist ein 1 zähniger Ligand , es steuert als Lewis-Base ein Elektronenpaar zur Bindungsbildung bei.
Das Hexa-aqua-Calcium(II)-Kation wirkt als Lewis-Säure und nimmt insgesamt 6 Elektronenpaare von den 6 Wassermolekülen als Liganden auf.
Das Hexa-aqua-Calcium(II)-Ion ist von 6 Wassermolekülen oktaedrisch koordiniert.
Jedes Wassermolekül steuerte 1 Elektronenpaar als Lewis-Base bei und ist somit ein 1-zähniger Ligand, im Sinne der Komplexchemie.
Ca(2+) * 2 Cl(-) + 6 | OH2(Lewis-Base) ⇌ [ Ca(–OH2)6 ](2+) * 2 Cl(-)
Skizze zum Hexa-aqua-Komplex des Calciumions
Chelat-Komplexe und Chelat-Liganden, chelatisierende Liganden, mehrzähnige Liganden
Chelat: gr. chele, dt. Krebsschere
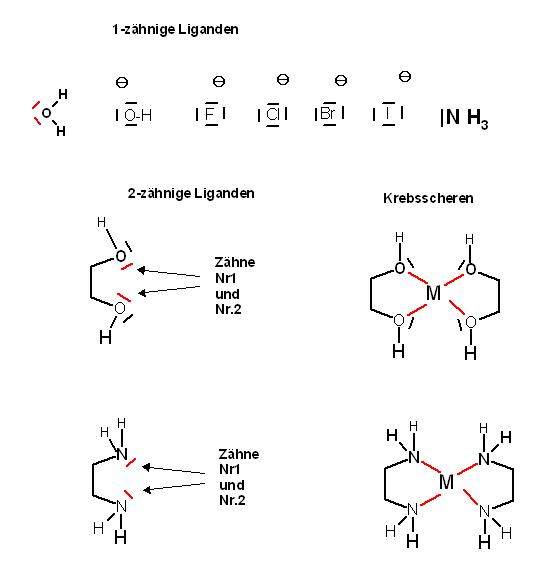
Beispiel mit sog. 2-zähnigen Liganden ( "Krebsscheren" )
Liganden: z.B.: 1,2-Ethandiol(Glycol), 2-Aminoethanol(Colamin), 1,2-Ethandiamin, Carbonation , Carboxylation etc.
Skizze
Skizze am Beispiel der dunkelblauen Kupfer(II)-Komplexe
.JPG](https://www.chemielounge.de/?qa=blob&qa_blobid=8826630019051128649)
Ethandiamin wirkt als 2-zähniger Ligand , es stellt 2 Elektronenpaare als Lewis-Base zur Verfügung.
Aus den oktaedrischen Hexa-aqua-Kupfer(II)-Ionen werden nun jeweils 4 einzähnige Liganden(Wassermoleküle) durch 2 Ethandiamin-Liganden ersetzt.
Ein Ethandiamin-Ligand liefert 2 Elektronenpaare die beiden Stickstoffatome eines solchen Chelat-Liganden greifen mit den freien Elektronenpaaren( "den Zähnen " ) das Metallion(hier das Kupfer(II)-Ion), wie eine Krebsschere.
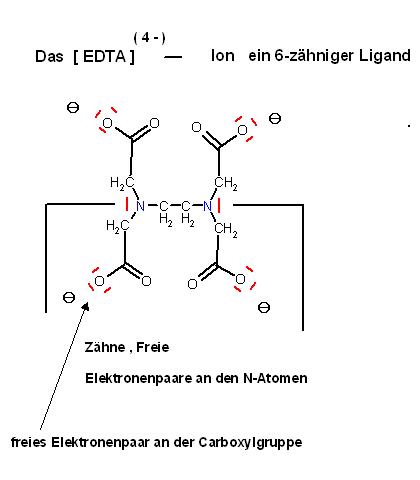
Zum EDTA
Das EDTA ist als Dinatrium-dihydrogen-EDTA im Handel, Na2H2EDTA. Das Tetra-Anion entsteht durch Deprotonierung mit einer Base, z.B.: Ammoniak-Ammonium-Puffer.
Das EDTA-Tetra-Anion ist ein 6-zähniger Ligand, es stellt insgesamt mindestens 6 Elektronenpaare als Lewis-Säure zur oktaedrischen Koordination zur Verfügung.
Hinweis die beiden freien Elektronenpaare an den beiden Stickstoff-Atomen sind 2 Koordinationsstellen und werden mitgezählt, des weiteren stellt jede Carboxylat-Gruppe jeweils 1 Elektronenpaar bereit.