Grüße chemweazle,
bin wieder viertelwegs genesen, deshalb so verspätet die Reaktion.
Zum Aufgabenblock
Berechnen Sie den pH-Wert und Wie ändert sich der pH-Wert
Aufgabe a). Titration einer verd. ,wäßr. HCl-Lösung
Aufgabe b). Herstellung eines HOAc-NaOAc-Puffers
Aufgabe c). Zugabe von Bariumhydroxid( 2säurige) starke Base
Eine Probe einer HCI-Lösung (c=0,10 mol/L. V = 10 mL) wird mit NaOH (c=0,10 mol/L)
titriert.
Aliquot:
Die zu titrierend wäßr. HCl-Lsg., Aliquot-Volumen, V(Aliquot) = 10 ml ,und c(HCl) = 0,1 mol / l = 0,1 mmol / ml
Maßlösung
0,1 m NaOH-Lsg. , c(NaOH) = 0,1 mol / l = 0,1 mmol / ml
a) Zeichnen Sie die Titrationskurve für diese Reaktion! Berechnen Sie dazu den pH-Wert
der Probe vor Zugabe von NaOH und den Verbrauch an NaOH bei Erreichen des
Aquivalenzpunktes!
____
Die Hydroniumionen-Konzentration und der pH-Wert der zu titrirenden Lsg, Aliquot , betragen:
c(H(+)) = c(HCl) = 0,1 mol / l = 10-1 mol / l
pH = – log10 ( c(H(+)) ) = – log10 ( c(HCl) )
pH = – log10 ( 10-1 mol / l * l / mol ) = – – 1 = + 1
Titration bis zum Erreichen des Äquivalenzpunkts (Neutralpunkt)
Am Äquivalenzpunkt liegt eine neutrale NaCl-Lösung vor.
H(+)(aq) + OH(-)(aq) → H2O
Es wurde beim Erreichen des Äquivalenzpunkts die äquivalente , gleiche Stoffmenge an Hydroxidionen aus der Maßlöung hinzuggeben, wie Hydroniumionen, H(+)-Ionen, im Aliquotvolumen vorlagen.
n(H(+))verbraucht = n(HCl)verbraucht = n(OH(-))hinzugegeben = n(NaOH)hinzugegeben
n(H(+))verbraucht = n(HCl) = c(HCl) * V(Aliquot) = c(NaOH) * V(NaOH)
n(H(+))verbraucht = n(HCl) = c(HCl) * V(Aliquot) = 0,1 [ mol / l ] * 0,01 l = 0,001mol = 1 mmol
n(NaOH)hinzugegeben = n(H(+))verbraucht = 0,001 mol = 1 mmol
$$V(NaOH) = \dfrac{n(NaOH}{c(NaOH)} = \dfrac{0,001\cdot mol\cdot l}{0,1\cdot mol}$$
$$V(NaOH) = \frac{0,001}{0,1}\cdot l =\frac{1}{1000}\cdot 10\cdot l = \frac{1}{100}\cdot l = 0,01\cdot l = 10 ml$$
Am Neutralpunkt(Endpunkt) ist die Hydroniumionen-Konzentration und der pH-Wert nur noch durch die schwache, geringfügige Eigendissoziation des Wassers bestimmt.
Eigendissoziation des Wassers<7p>
H2O → H(+)(aq) + OH(-)(aq)
Bei der Temperatur von 25 °C sind 10-7 mol / l der Wasser-Moleküle in 10-7 mol / l H(+)-Ionen und 10-7 mol / l Hydroxidionen dissoziert.
Das Ionenprodukt, bei θ = 25 °C, lautet: Kw = c(H(+)) * c(OH(-)) = 10-14 mol2 * l-2
c(H(+)) = c(OH(-)) = 10-7 mol / l
pH = 7 = pOH
Skizze der Titrationskurve, rot : saurer Bereich, grüner Punkt: Äquivalenzpunkt, blau: NaOH-Überschuß-Teil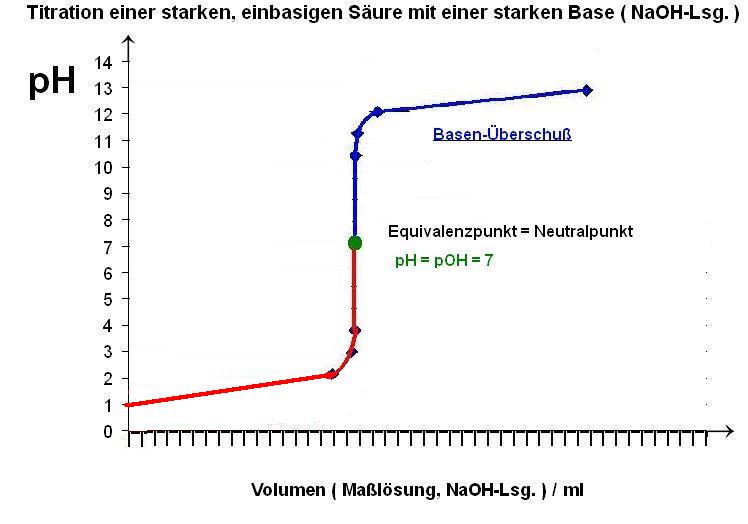
Aufgabe b)., HOAc-AcO(-)-Puffer
b) Ein Gemisch aus Essigsäure und Natriumacetat (NaCH3COO) ist ein häufig verwendetes Puffersystem. Berechnen Sie den pH Wert des resultierenden Puffers wenn zu verdünnter Essigsäure (0,060 mol in 250 mL Gesamtvolumen) 0,030 mol festes Natriumacetat (NaCH3COO) gegeben werden!
Die Volumenänderung durch die Zugabe von Natriumacetat wird vernachlässigt.
c) Wie ändert sich der pH-Wert, wenn in dieser Lösung 0,005 mol Ba(OH)2 gelöst werden? Auch hier wird die Volumenänderung als vernachlässigbar angenommen.
Konjugierte Säure : Essigsäure, Ethansäure, HOOC-CH3, Abkürzung : HOAc
Konjugierte Base: Acetation aus Natriumacetat, CH3COO(-) aus NaCH3COO ; abgekürzt: mit AcO(-) und NaOAc
Die Abkürzung Ac steht für den Acetyl-Rest, CH3-CO-
Henderson-Hasselbalch-Gleichung
$$ pH = pKs(HOAc) + log_{10}\left[\dfrac{c(konjugierte Base) }{c(konjugierte Säure)}\right]$$
$$pH = pKs(HOAc) + log_{10}\left[\dfrac{c(^{(-)}OAc)}{c(HOAc)}\right]$$
Anmerkung : Das Konzentrationsverhältnis ist auch gleich das Stoffmengen-Verhältnis.
Im Bruchterm des Konzentrationsverhältnisses kürzt sich das Volumen der Puffergemisch-Lösung, V , heraus.
$$\dfrac{c(^{(-)}OAc)}{c(HOAc)} = \dfrac{n(^{(-)}OAc)\cdot V}{n(HOAc)\cdot V}$$
Oder man kann den Bruchterm auch mit dem Faktor 1 = [ V / V ] erweitern.
$$\dfrac{c(^{(-)}OAc)}{c(HOAc)} = \dfrac{c(^{(-)}OAc)}{c(HOAc)}\cdot \frac{V}{V} = \dfrac{n(^{(-)}OAc)}{n(HOAc)}$$
Konzentrationen
Konjugierte Säure, HOAc : c(HOAc) = 0,06 mol / 0,25 l = 0,24 mol / l
Konjugierte Base, NaOAc, c(NaOAc) =c (AcO(-) ) = 0,03 mol / 0,25 l = 0,12 mol / l
$$\dfrac{c(^{(-)}OAc)}{c(HOAc)} = \dfrac{n(^{(-)}OAc)}{n(HOAc)} = \frac{0,03\cdot mol\cdot 0,25\cdot l}{0,25\cdot l0,06\cdot mol} = \frac{1}{2} = 0,5$$
$$pH = 4,75 + log_{10}\left(\frac{1}{2}\right)$$
pH = 4,75 + log10(1) – log10(2)
pH = 4,75 + 0 – log10(2)
pH ≈ 4,7500 – 0,3010 = 4,449 ≈ 4,45
Zu c).
Zugabe der starken 2-säurigen, 2-wertigen Base, wasserfreies Bariumhydroxid, Ba(OH)2
Zugabe der starken 2-säurigen, 2-wertigen Base, wasserfreies Bariumhydroxid, Ba(OH)2
Setzt man z.B. eine 1 molare Bariumhydroxid-Lsg. an, so sind in einem Volumen von einem Liter 1 mol hydratisierte Barium(II)-Kationen aber 2 mol Hydroxidionen gelöst.
n(OH(-)) = 2 * n(Ba(2+)) und c(OH(-)) = 2 * c(Ba(2+))
0,005 mol Bariumhydroxid liefert gelöst 0,005 mol Barium(II)-Ionen und die doppelte Stoffmenge an OH(-)-Ionen, also 2 * 0,005 mol = 0,01 mol.
Dem oben erwähnten Essigsäure-Acetat-Puffergemisch wurden nun insgesamt 0,01 mol Hydroxidionen zugegeben.
Jedes OH(-)-Ion reagiert mit einem 1 HOAc-Molekül zu einem Wassermolekül und dabei wird ein zusätzliches Acetation erzeugt.
0,01 mol OH(-)-Ionen fangen 0,01 mol Essigsäure ab und die Stoffmenge der Acetationen erhöht sich um 0,01 mol, dabei nimmt die Stoffmenge an Essigsäure um 0,01 mol ab.
HOAc(aq) + OH(-)(aq) ⇌ AcO(-)(aq) + H2O
Stoffmengen an HOAc und Acetat in dem Viertel Liter ( V = 0,25 l ) vor der Zugbe an Bariumhydroxid
n(HOAc) = 0,06 mol und n(AcO(-)) = 0,03 mol
Stoffmengen an HOAc und Acetat in dem Viertel Liter nach der Zugabe von 0,01 mol OH(-)-Ionen aus 0,005 mol Bariumhydroxid
n(HOAc) = 0,06 mol – 0,01 mol = 0,05 mol
n(AcO(-)) = 0,03 mol + 0,01 mol = 0,04 mol
Die neuen Konzentrationen an HOAc und Acetat im Viertel Liter (0,25 l) Gemischvolumen
$$c(HOAc) = \dfrac{0,05\cdot mol}{0,25\cdot l} = 0,2\cdot \frac{mol}{l}$$
$$c(AcO^{(-)}) = \dfrac{0,04\cdot mol}{0,25\cdot l} = 0,16\cdot \frac{mol}{l}$$
$$\dfrac{c(AcO^{(-)})}{c(HOAc)} = \dfrac{n(AcO^{(-)})}{n(HOAc)} = \frac{0,04\cdot mol}{0,05\cdot mol} = \frac{4}{5} = \frac{8}{10}$$
pH = 4,75 + log10(0,8) ≈ 4,75 – 0,097 ≈ 4,653 ≈ 4,65