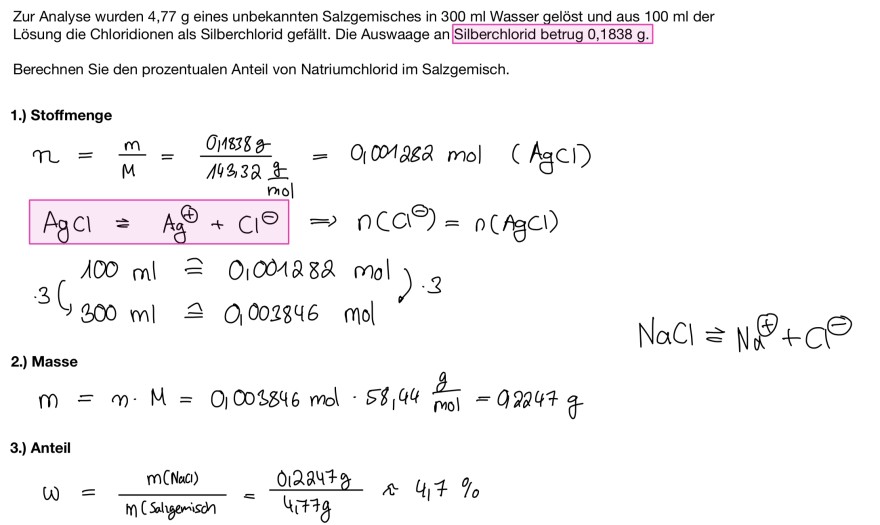
Text erkannt:
Zur Analyse wurden 4,77 g eines unbekannten Salzgemisches in \( 300 \mathrm{ml} \) Wasser gelöst und aus \( 100 \mathrm{ml} \) der Lösung die Chloridionen als Silberchlorid gefällt. Die Auswaage an Silberchlorid betrug \( 0,1838 \mathrm{~g} \).
Berechnen Sie den prozentualen Anteil von Natriumchlorid im Salzgemisch.
1.) Stoffmenge
\( \begin{array}{l} n=\frac{m}{M}=\frac{0,1838 \mathrm{~g}}{143,32 \frac{\mathrm{g}}{\mathrm{mol}}}=0,001282 \mathrm{~mol} \text { ( AgCl) } \\ \mathrm{AgCl}=\mathrm{Ag}^{\oplus}+\mathrm{Cl}^{\ominus} \Rightarrow n\left(\mathrm{Cl}^{\ominus}\right)=n(\mathrm{AgCl}) \\ \cdot 3\binom{100 \mathrm{ml} \cong 0,001282 \mathrm{~mol}}{300 \mathrm{ml} \cong 0,003846 \mathrm{~mol}} \cdot 3 \\ \end{array} \)
\( \mathrm{NaCl} \approx \mathrm{Na}^{\oplus}+\mathrm{Cl}^{\ominus} \)
2.) Masse
\( m=n \cdot M=0,003846 \mathrm{~mol} \cdot 58,44 \frac{\mathrm{g}}{\mathrm{mol}}=92247 \mathrm{~g} \)
3.) Anteil
\( \omega=\frac{m(\text { Naal })}{m(\text { Salgemisch }}=\frac{0,2247 \mathrm{~g}}{4,77 \mathrm{~g}} \approx 4,7 \% \)
Das Ganze kannst du auch noch als Video auf YouTube ansehen: https://youtu.be/2y2PkM8HvMI