Salut limonade,
hm........
Ich versuche es mal etwas anders:
H2SO4 - wir haben 1x S mit 6 Valenzelektronen, 4x O mit jeweils 6 Valenzelektronen und 2x H mit jeweils einem Außenelektron (Abb. a).
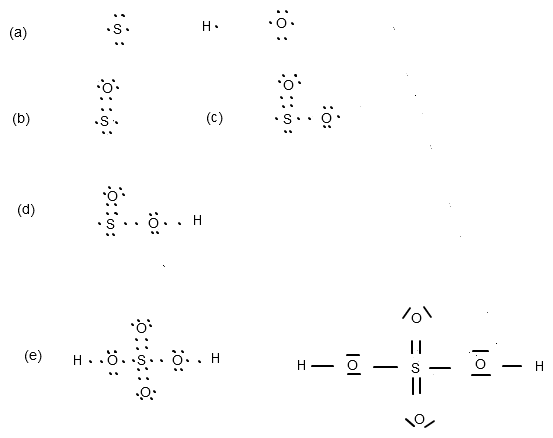
(eigenhändige Grafik)
Schwefel ist das Zentralatom, mit dem wir anfangen.
Doppelbindungen kannst du nun dort setzen, wo sich beim S zwei Elektronen aufhalten, also oben und unten (Abb. a). Bei Abbildung b habe ich das erste O-Atom eingezeichnet. Zwei seiner Elektronen stehen nun genau über den beiden oberen des Schwefels. Die restlichen 4 Elektronen des Sauerstoffs werden leicht verschoben als "Hütchen" draufgesetzt. Das wiederholst du nun "unten" am S-Atom (mit druntergesetztem Hütchen :)) und hast dann damit bereits 2 Sauerstoff-Atome untergebracht.
Rechts und links vom S haben wir jeweils nur ein Elektron und somit keine Möglichkeiten mehr für weitere Doppelbindungen. Du schnappst dir jetzt das dritte O-Atom und stellst es mit seinem einzelnen Elektron wie in Abbildung c dem S-Atom rechts zur Seite. Die übrigen Elektronen des O-Atoms bleiben an ihrem Platz. Dies nun analog auf der linken Seite des S-Atoms mit einem einzelnen Elektron des vierten und letzten O-Atoms.
So, die beiden verbliebenen H-Atome mit je einem Elektron suchen sich nun auch jeweils einen Platz, an dem sich bereits ein einzelnes Elektron befindet. Abbildung d zeigt die Stellung des ersten H-Atoms. Dies nun auf der linken Seite des S-Atoms ergänzen.
Finalement müsstest du nun Abb. e erreicht haben. Jeweils zwei Punkte (also 2 Elektronen) noch zu je einem Strich verbinden und du hast es geschafft !
(Ich werde demnächst eine bessere Grafik anfertigen, aber momentan spinnt mein Handy und verweigert das Hochladen. Für den Anfang und zum besseren Verständnis reicht aber obige Skizze.)
Fällt dir übrigens etwas auf bezüglich der Oktettregel ? Schau dir den Schwefel in der Verbindung an und du wirst 12 statt 8 Elektronen zählen ! Diese Öffnung der Oktettregel gilt für Elemente ab der 3. Periode.
Viel Erfolg !