Salut aamteuer,
zu deiner ersten Frage schau bitte meine Skizze:
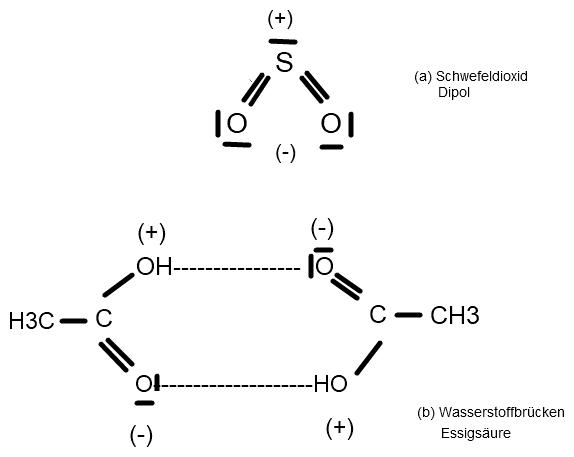
Summenformel Schwefeldioxid: SO2
Summenformel Essigsäure: C2H4O2
Vor die Partialladungen setze bitte jeweils ein δ (delta).
Zu den schwachen Partialladungen im Methan - Molekül (CH4):
Das C - Atom ist leicht elektronegativer als das H - Atom. Wir haben dabei eine EN - Differenz von 0,4, wodurch sich eine sehr leichte Polarisation ergibt.
Ein Dipolmoment ist dennoch nicht vorhanden, da durch den tetraedrischen Bau des Moleküls die Schwerpunkte von positiver und negativer Partialladung zusammenfallen, d.h. die Polaritäten der Bindungen heben sich gegenseitig auf, wodurch das Molekül wieder unpolar ist.
Zu den Siedepunkten von Ammoniak und Methan:
Ammoniak ist ein Molekül mit polaren Bindungen und einem permanenten Dipol. Darüberhinaus ist Ammoniak in der Lage, Wasserstoffbrückenbindungen auszubilden. Dies erklärt den weitaus höheren Siedepunkt im Vergleich zu Methan, denn Methan verfügt lediglich über schwache van-der-Waals-Kräfte.
Was ist ein Dipol ?
Grob kann man sagen, dass ein Molekül dann ein Dipol ist, wenn die Differenz der Elektronegativitäten > 0,4 und die Asymmetrie des Moleküls nach außen gegeben ist.
Viel Erfolg :)