Salut,
Elektronenkonfiguration von Chlor:
Zunächst ein paar Dinge, die du vorab wissen müsstest:
Eine Elektronenkonfiguration gibt immer Auskunft über die Verteilung der Elektronen eines Atoms auf die verschiedenen Orbitale.
(In der Schule sind dabei meist nur s-Orbitale, p-Orbitale und d-Orbitale von Bedeutung,)
Wie viele Elektronen können sich nun in diesen Orbitalen aufhalten ?
In ein s-Orbital, das energieärmste Orbital, passen 2 Elektronen.
Ein p-Orbital ist mit 6 Elektronen komplett gefüllt.
(Ein d-Orbital kann 10 Elektronen beherbergen, benötigen wir aber für deine Aufgabe nicht.)
An dieser Stelle musst du nun noch die Reihenfolge der zu besetzenden Orbitale kennen (und lernen). Sie sind stets sortiert nach steigendem Energiegehalt:
1s 2s 2p 3s 3p 4s 3d 4p 5s...
(1,2,3 etc. bezeichnen übrigens die jeweilige Schalennummer.)
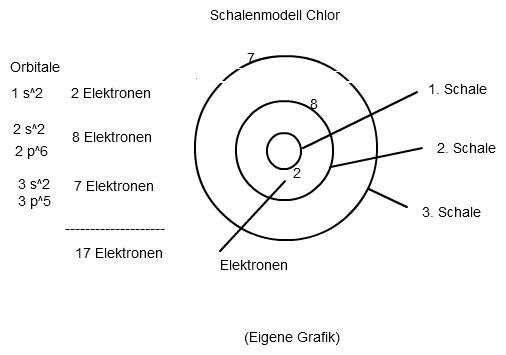
Weiterhin benötigst du die Anzahl der Elektronen von Chlor. Diese findest du in jedem Chemiebuch im Periodensystem der Elemente (PSE). Chlor hat die Ordnungszahl 17, besitzt also 17 Protonen und 17 Elektronen. Diese 17 Elektronen verteilst du nun auf die verschiedenen Orbitale, je nach deren Fassungsvermögen (s.o) :
1s ⇒ 2 Elektronen (vollbesetzt)
2s ⇒ 2 Elektronen (vollbesetzt)
2p ⇒ 6 Elektronen (vollbesetzt)
3s ⇒ 2 Elektronen (vollbesetzt)
3p ⇒ 5 Elektronen (kein vollbesetztes Orbital, da nur noch 5 von 17 Elektronen übrig waren.)
Die Anzahl der Elektronen schreibst du nun hochgestellt hinter das jeweilige Orbital und fertig wäre damit deine Elektronenkonfiguration des Elementes Chlor:
1s2 2s2 2p6 3s2 3p5
Aus dieser Erkenntnis heraus könntest du beispielsweise auch das Schalenmodell zeichnen:
Wenn das Erstellen einer Elektronenkonfiguration ein völlig neues Thema für dich ist, würde ich mich zunächst vielleicht an Elementen der 2. oder 3. Periode versuchen. Bei Nebengruppen - Elementen gibt es teilweise schon Fallstricke und Ausnahmen. Mit der Hundschen Regel und dem Pauli - Prinzip müsste man sich dann später noch in Verbindung mit Energieniveaudiagrammen beschäftigen. Ich denke aber, dass das noch Zeit hat.
Viel Erfolg und melde dich bitte bei Unklarheiten !