Salut,
im Schalenmodell sieht das alles folgendermaßen aus:
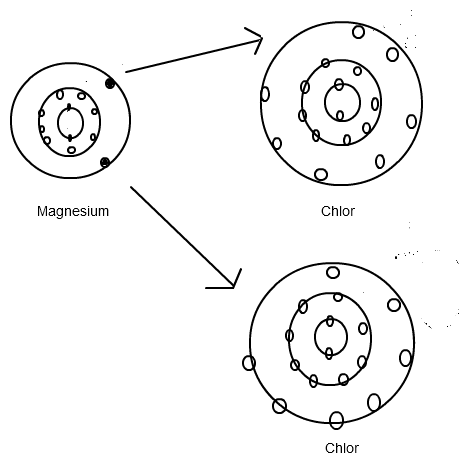
Magnesium steht in der II. Hauptgruppe, besitzt somit 2 Außenelektronen, die es, wie andere Metalle auch, gerne abgeben möchte. Chlor befindet sich in der VII. Hauptgruppe, hat also 7 Valenzelektronen. Zur Erreichung des angestrebten Edelgaszustandes, d.h. eine vollständige Anzahl von 8 Außenelektronen, muss Magnesium 2 Elektronen abgeben und Chlor diese aufnehmen. Nun kann Chlor aber nur 1 Elektron aufnehmen, was wiederum bedeutet, dass für diese Reaktion eben 2 Chloratome vonnöten sind.
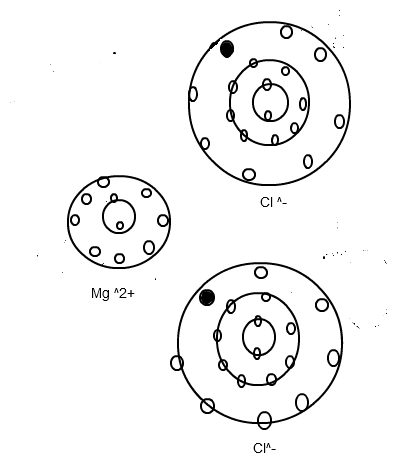
Wie du siehst, hat nun Magnesium seine äußere Schale (M - Schale) bzw. seine beiden Außenelektronen abgegeben und ist damit zweifach positiv geladen. Die nun letzte Schale (L - Schale) ist mit 8 Elektronen vollbesetzt und die Edelgaskonfiguration dadurch erreicht. Die beiden Chloratome haben jeweils 1 Elektron vom Magnesium aufgenommen, sind dadurch einfach negativ geladen und erreichen durch ihre nun jeweils mit 8 Elektronen komplett gefüllte Außenschale ebenfalls die Edelgaskonfiguration.
Die dazugehörige Reaktionsgleichung:
Mg + Cl2 → MgCl2
Schöne Grüße :)