Hi, hier chemweazle,
Die alkalische Hydrolyse, Spaltung von Stärke
Zunächst
Acetale(Vollacetale) lassen sich nicht mit Basen als Katalysatoren hydrolysieren.
Acetale(Vollacetale) lassen sich nur mit Säuren oder die Stärke mit Säure oder passenden Enzymen(z.B. Diastase) als Katalysatoren hydrolysieren. Die Hydrolyse von Acetalen ist die Umkehrreaktion der Acetalisierung von Aldehyden mit Alkoholen.
Die Stärke besteht aus Amylose und Amylopektin.
In beiden Verbindungen sind die Alpha-D-Glucose-Monomer-Einheiten acetalisch verknüpft. Es handelt sich bei beiden Verbindungen um Polyacetale oder Acetalpolymere.
Bei der Amylose sind die Alpha-D-Glucose-Monomere mit OH-Gruppen der Ringatome 1,4- verknüpft.
Skizze mit der Konformationsformeldarstellung(Sesselformringen)
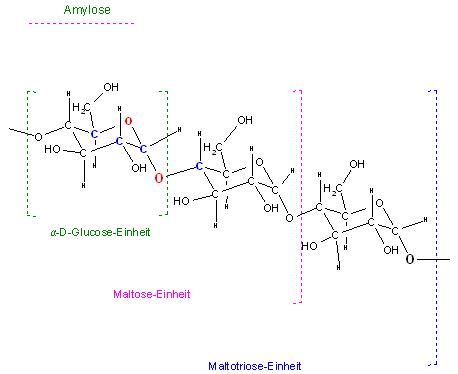
Skizze Ausschnitt von 3 Alpha-D-Glucose-Einheiten in Harworth-Darstellung
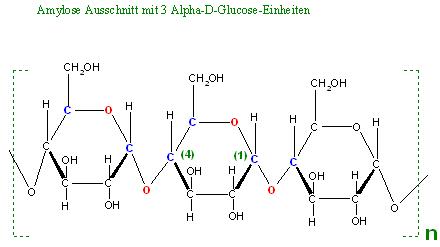
Text erkannt:
Amylose Ausschnitt mit 3 Alpha-D-Glucose - Einhe iten
Bei dem Amylopektin tritt zusätzlich noch eine 1,6-Verknüpfung der Alpha-D-Glucose-Monomere mit der prim. Alkoholgruppe, der (CH2-OH-Gruppe) als Verzweigung auf, das ist am Glucopyranosering die Seitenkette mit dem C-Atom Nr. 6.
Skizze
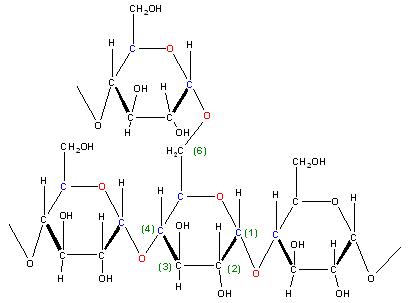
Es sind Acetale, auch Vollacetale genannt.
Die Hydrolyse der Amylose und des Amylopektins ist vom Reaktionstyp her eine Acetalspaltung.
Acetale(Vollacetale), gemeint sind hier nur die Sauerstoff-Sauerstoff-Acetale(O-,O-Acetale):
R-CH(OR´)2
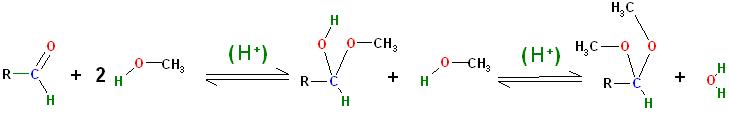
Bei der Acetalisierung eines Aldehyds wird der doppelt gebundene Sauerstoff der Aldehydgruppe durch zwei Alkoxyreste ersetzt. Die Umkehrreaktion ist die Hydrolxse der Acetale zu den Produkten :Aldehyd und Alkohol.
| Säurekatalyse: (H(+)) |
| Hydrolyse → |
| R-CH(OR*)2 + H2O <====> R-CH=O + 2 R*OH |
| ← Acetalisierung |
Als Zwischenprodukte treten die Halbacetale auf. Die aliphatischen Halbacetale lassen sich in der Regel nicht in Substanz isolieren.
Hingegen lassen sich viele cyclische Halbacetale in Reinform isolieren, manche kristallisieren sogar, z.B. Alpha-D-Glucose.
Eine kleine Zusammenstellung verschiedener Acetale mit unterschiedlichen Konstitutionen, die man in Lehrbüchern nicht auf einmal zusammengefaßt findet.
Bildung, Acetalisierung und die Umkehrreaktion, Acetalspaltung in zwei Stufen
Fall 1 aliphatischer Aldehyd mit aliphatischen Alkohol
Skizze
Fall 2 aliphatischer Aldehyd mit z.B. 1,2-Diolen oder 1,3- Diolen
Skizze

In den Fallbeispielen 1 und 2 sind in der Regel die Zwischenprodukte, die Halbacetale, nicht in Substanz isolierbar.
Fälle 3 und 4 g- und d-Hydroxy-Aldehyde mit z.B. Methanol
Skizze
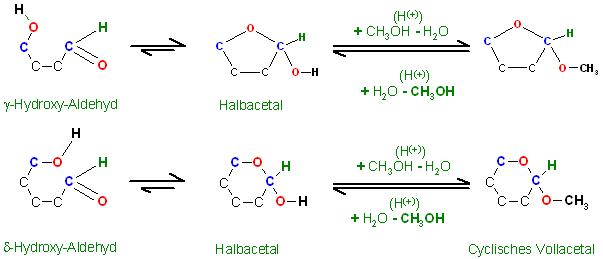
Diese Hydroxy-Aldehyde besitzen das gleiche Kohlenstoffskelett wie die Aldosen. Die analogen Cyclischen Halbacetale lassen sich in einigen Fällen isolieren, manche fallen auch kristallin an. In Lösung steht die offenkettige Hydroxy-Aldehydform mit der cyclischen Halbacetalform im dynamischen Gleichgewicht. Oft liegt das Gleichgewicht mehr auf der Seite der cycl. Halbacetalform, z.B. Glucose liegt über 90%, vom Stoffmengenanteil her, in der Halbacetalform in wässriger Lösung vor.
Den Mechanismus der säurekatalysierten Spaltung von Amylose mit Wasser kann ich erst beim nächsten Post liefern
Grüße chemweazle