Hi, hier chemweazle,
Gleichgewichtsreaktion Stickstoffdioxid zu Distickstofftetraoxid?
Zu 5.1 und 5.2
Dimerisierung des Stickstoffdioxides und Homolyse des Distickstofftetroxides
Reaktionsgleichung
2 O2N(g)(braun) ⇌ O2N-NO2(g)(farblos)
Gleichgewichtskonstante Kc(T):
$$K_{c}(T) = \dfrac{[N_{2}O_{4}]}{[NO_{2}]^{2}}$$
Die Lage des Gleichgewichtes ist druckabhängig. 2 mol Stickstoffdioxid dimerisieren zu 1 mol Distickstofftetroxid.
Bei Druckerhöhung wird das Dimerisierungsgleichgewicht zur Seite des Distickstofftetroxides, Dimer, verschoben, die Konz. an N2O4 vergrößert sich bei Druckzunahme.
Prinzip nach Le Chatellier
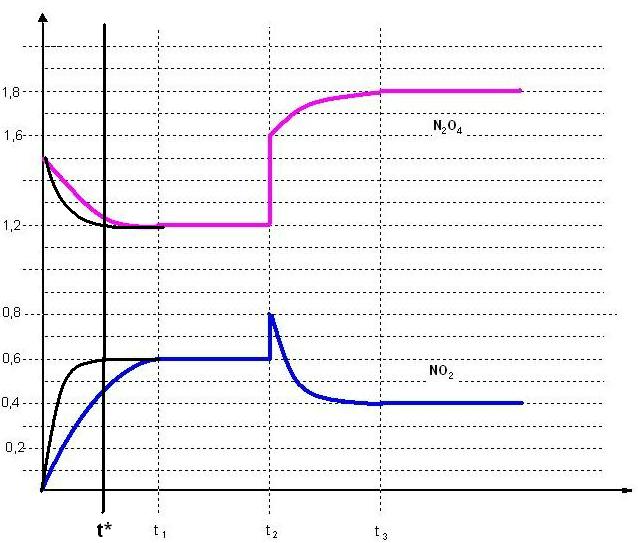
Gleichgewichtskonzentrationen der Reaktionspartner im Zeitintervall von t1 bis t2:
Anmerkung: Die Gleichgewichtskonzentrationen werden mit dem tiefgestellten suffix "gl" abgekürzt.
[ ]gl
[NO2]gl = 0,6 mol/l
[N2O4]gl = 1,2 mol/l
$$K_{c}(T) = \dfrac{1,2\cdot mol\cdot l^{2}}{0,6^{2}\cdot mol^{2}\cdot l} = \frac{1,2\cdot l}{0,36\cdot mol} = \frac{120}{36}\cdot \frac{l}{mol} = \frac{12\cdot 10}{3\cdot 12}\cdot \frac{l}{mol} = \frac{10\cdot l}{3\cdot mol}$$
Kc(T) = 3,33333 * l/mol
Das Gleichgewicht liegt wie aus dem Diagramm ersichtlich deutlich auf der Seite des Dimeren, dem Distickstofftetroxid.
Skizze
Anm.: Die Skizze wurde von mir nachgezeichnet, mit Hilfe von ISIS-Draw und MS-Paint.
Zu 5.3
Reaktionsdurchführung mit Katalysator bei gleichen Bedingungen:
Die eingezeichneten Konzentrationsverlaufs-Kurven sind nach meiner Meinung schon ok. Die Gleichgewichtskonzentrationen werden früher erreicht. Der Gleichgewichtszustand ist schneller erreicht. Die Lage des Gleichgewichtes wird durch den Katalysator, wie es sich gehört, nicht verändert. Ein Katalysator beschleunigt nur die Reaktion, erhöht aber die Ausbeute nicht. Der Gleichgewichtszustand ist an der Konstanz der Konzentrationen, zu erkennen.
Der Gleichgewichtszustand ist schon zum Zeitpunkt t* vor dem Zeitpunkt t1 erreicht
Zu 5.4
Druckänderung , Druckerhöhung
Das entspricht der Erwartung aus der Reaktionsgleichung. Druckzunahme verschiebt das Gleichgewicht auf die Seite des Distickstofftetroxides.
Die stöchiometrischen Koeffizienten sind auf der linken Seite der Reaktionsgleichung höher, als auf der rechten Seite, 2>1.
.Wenn man bei einem Gas oder Gasgemisch der Druck steigern möchte, so muß man das Volumen des Gases verkleinern, d.h. das Gas muß komprimiert werden. Durch die Volumenabnahme steigen die Konzentrationen an.
$$p = \frac{n}{V}\cdot R\cdot T = c\cdot R\cdot T$$
Die NO2-Konzentration steigt ab dem Zeitpunkt t2 von 0,6 mol/l auf 0,8 mol/l. Die N2O4-Konzentration steigt zunächst von 1,2 mol/l auf 1,6 mol/l an.
Das ist nur durch die Kompression des Gases zur Druckerhöhung verursacht.
Innerhalb des Zeitintervalls zwischen t2 und t3 verlaufen die Kurven im Konzentration-Zeit-Diagramm parabelähnlich, bogenförmig.
Hier verschiebt sich die ursprüngliche Lage des Gleichgewichtes, es wird das ursprüngliche Gleichgewicht nach rechts zur Seite des Distickstofftetroxides verschoben.
Das Reaktionsgemisch agiert durch Verminderung der Gesamtteilchenzahl pro Volumen, das ist die Minderung der Gesamtteilchenkonzentration, auf die Druckerhöhung, dem Äusseren Zwang. (Le Chatellier)
Aus jeweils 2 freien beweglichen NO-Teilchen wird jeweils ein frei bewegliches N2O4-Teilchen.
Ab dem Zeitpunkt t3 ist das neue Gleichgewicht eingestellt.