Hi, hier chemweazle, keine Ahnung, ob das jetzt sehr viel weiterhilft
Zu
1. Nummeriert auf dem Arbeitsblatt die Aminosäure-Reste mit der Primärstruktur!
2. Kennzeichnet die verschiedenen Reste der Aminosäuren farbig:
a. polare Reste: grün
b. unpolare Reste: gelb
c. saure Reste: rot
d. basische Reste: blau
Aminosäuren im Rinder-Insulin, Gesamtzahl: 51
Sorten der Aminosäuren
- Gly: Glycin, unpolar
- ILeu: Isoleucin, unpolar
- Val: Valin, unpolar
- Gln: Glutamin, polar, wegen C=O-NH2-Gruppe
- Cys: hier Cystin, unpolar
- Ala: Alanin, unpolar
- Ser: Serin, polar
- Leu: Leucin, unpolar
- Asn: Asparagin, polar, wegen C=O-NH2-Gruppe
- Phe: Phenylalanin, unpolar
- His: Histidin, basisch, Stickstoffatom im Imidazolring
- Glu: Glutaminsäure, sauer, wegen CO2H-Gruppe
- Arg: Arginin, basisch, wegen dem Guanidylrest am C(5)-Atom, 2HN-(C=NH)-NH-
- Thr: Threonin, polar
- Pro: Prolin, unpolar
- Lys: Lysin, basisch, NH2-Gruppe in der Seitenkette
| sauer | basisch |
| Glu | His, Arg, Lys |
| unpolar | polar |
| Gly, ILeu, Val, Cys, Ala, Leu, Phe, Pro | Gln, Ser, Asn, Thr |
Skizze
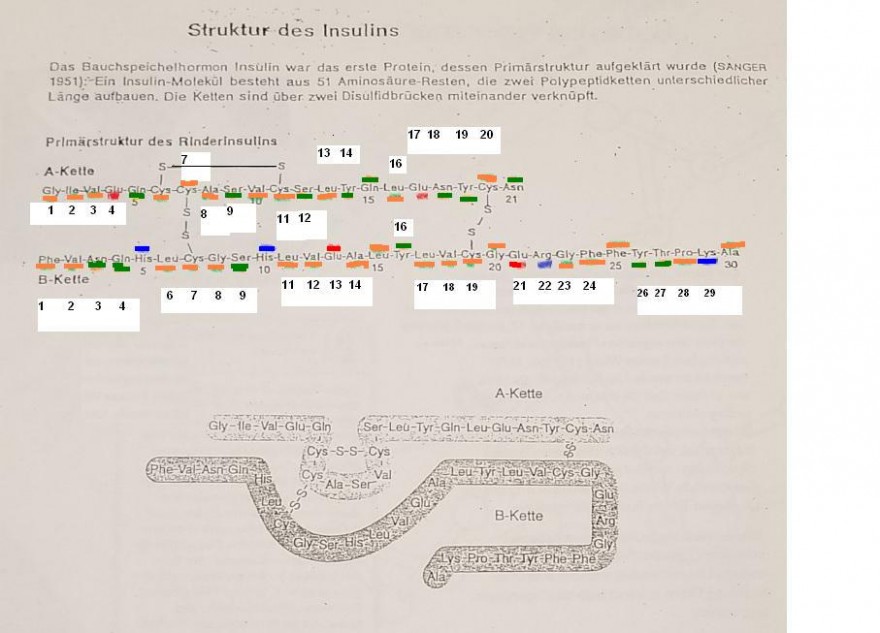
Skizze

Zu3. Beschreibt, durch welche Bindungsarten die Konformation des Insulin-Moleküls stabilisiert wird (Kennzeichnungen)! a). Dipol-Dipol-Anziehungskräfte( „Keesom-Kräfte“ ), Wasserstoffbrückenbindungen
b).Kation-Anion-Anziehungskräfte( „Coulomb-Kräfte“ ) zwischen z. B. dem Imidazolium-Kation des Aminosäurerestes Histidin und dem Carboxylation der konjugierten Base des Glutaminsäure-Restes, sog. Ionische Bindung
c).und / oder Kation-Anion-Anziehungskräfte( „Coulomb-Kräfte“ ) zwischen dem Ammoniumion an der Seitenkette der Aminosäure Lysin und dem Carboxylation der konjugierten Base des Glutaminsäure-Restes, Ionische Bindung
Im Bildausschnitt in dem nur die alpha-C-Atome der einzelnen Aminosäure-Reste dargestellt sind, sieht man zwischen dem Aminosäure-Rest Nr 10, Histidin, basisch, und dem Aminosäure-Rest Nr 13, Glutaminsäure-Rest, sauer, einem kurzen Abstand zwischen den Alpha-C-Atomen.
Bild
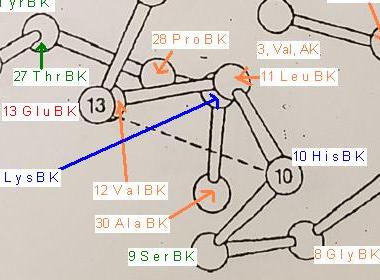
Bild
Säure-Base-Reaktion zwischen dem Glutaminsäure-Rest und der basischen Gruppe des Histidin-Restes, der Imidazol-Ring.
Der Imidazol-Ring wird am freien Elektronenpaar protoniert. Es entsteht ein Imidazoliumion, ähnlich dem Ammoniumion oder dem Pyridiniumion. Zwischen dem Carboxylation (Anion) und dem Imidazoliumion(Kation) treten Elektrostatische Anziehungskräfte auf (Coulomb-Kräfte) ( Ionische Bindung).
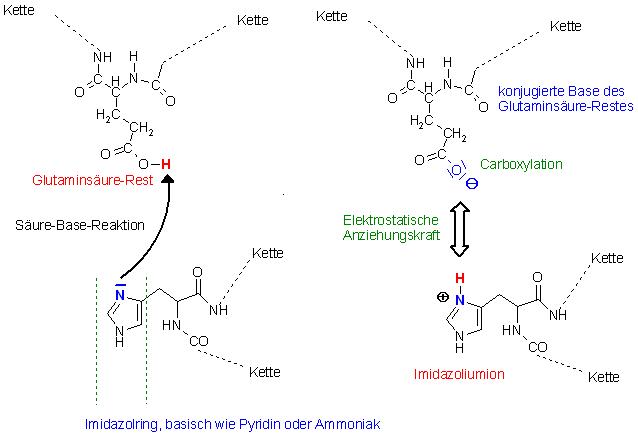
Zu
4. Welche Auswirkung hat die Disulfidbrücke innerhalb der A-Kette?Sie bewirkt die Ringstruktur zwischen den Aminosäure Nr 6, Cystein und der Aminosäure Nr. 11, Cystein innerhalb der A-Kette. Ohne diese wäre der Ring innerhalb der A-Kette nicht vorhanden, außerdem verbinden 2 Disulfid-Brücken (Disulfan-Gruppen) die A-Kette mit der B-Kette.
Anders betrachtet kann man sich die beiden Aminosäurereste Nr. 6 und Nr. 11 als eine einzige Aminosäure betrachten, nämlich das Cystin.
Skizze zu Cystein und Cystin
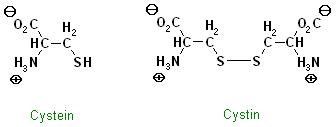
Zu
5. Beschreibt das Löslichkeitsverhalten im Zentrum und im äußeren Teil des Insulin-Moleküls!
Mal aus den Fingern gesaugt, aber ehrlich mehr reine Spekulation
Wenn die polaren Gruppen an den Seitenketten der Aminosäure-Reste nach innen , also ins Innere des Proteins zeigen bzw. ausgerichtet sind. Dann ist das Innere eher hydrophiler, als die äußere. lipophile Oberfläche des Proteins.
Hm, na ja!