Gruß chemweazle,
Zu
Zimtsäure aus Wittig herstellen
Kann mir jemand sagen wie man zimtsäure mit wittig herstellt?
Anmerkung: Das Wittig-Reagenz nenne ich Alkylidenphosphoran, wie in den Organometallchemie-Lehrbüchern. Man geht hier mehr von der Ylen-Form in der Mesomeren-Grenzformel-Schreibweise aus und vernachlässigt die Ylid-Form. Die Kohlenstoff-Phosphor-Doppelbindung wird dabei sehr ernst genommen.
Aber man muß das nicht unbedingt tun.
Skizze
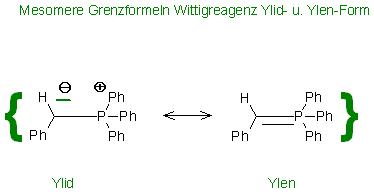
1. Die Wittig-Olefinierung von Benzyliden-Triphenyl-phosphoran mit Glyoxylsäureester liefert ein Diastereomerengemisch von cis- und trans-3-Phenyl-Acrylsäureethylester
Das trans-Diastereomer ist der Zimtsäureethylester
Ph-CH=PPh3 + O=CH-CO2Et → Ph-CH=CH-CO2Et + O=PPh3
Skizze
Edukte und Ihre Darstellungen
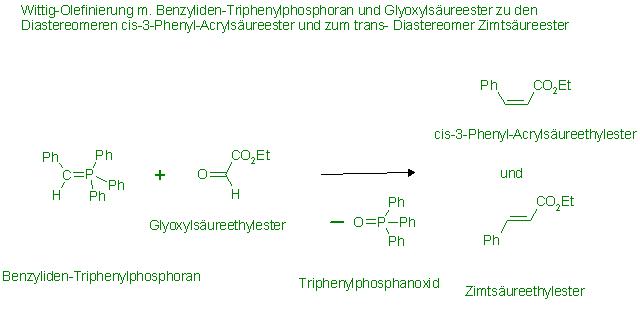
Darstellungsweg 1 für das Wittig-Reagenz: Benzyliden-Triphenylphosphoran, Ph-CH=PPh3
Weg 1
Alkylierung von z.B. Triphenylphosphan mit Benzylhalogenid(Benzylchlorid, -bromid oder-iodid) zum quart. Phosphoniumsalz (Menschutkinreaktion) und anschließende Deprotonierung mit Superbasen, zB. mit: NaNH2, Lithium-di-isopropylamid(LDA), Bu-Li
1. Stufe, Menschutkinreaktion Ph-CH2-X + IPPh3 → Ph-CH2-PPh3(+) * X(-)(quart. Phosphoniumsalz)
2. Stufe, Deprotonierung Ph-CH2-PPh3(+) * X(-)(quart. Phosphoniumsalz) + Bu-Li → Ph-CH=PPh3 + C4H10(g) ↑ * LiX
Skizze 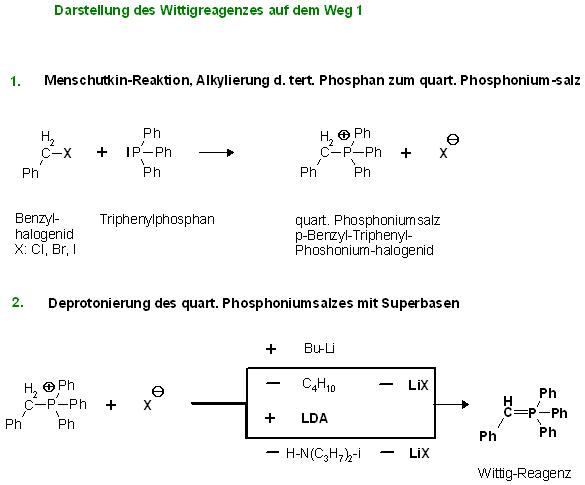
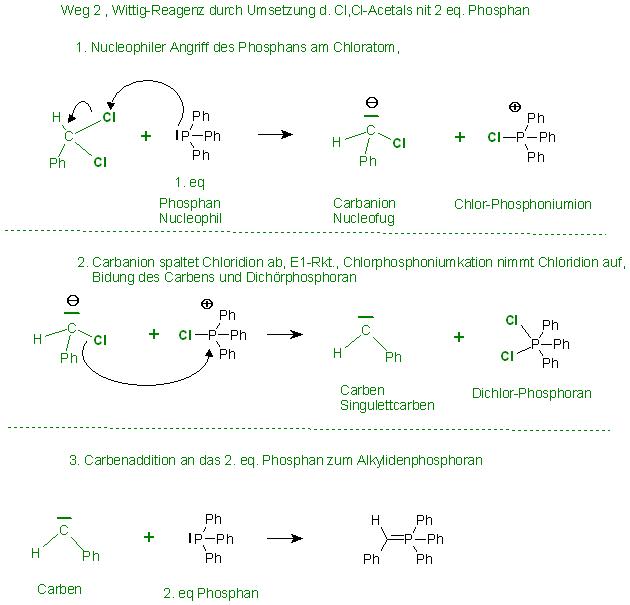
Weg 2
Erzeugung des Chlor-,Chlor-Acetals durch Austausch des Carbonylsauerstoffes durch 2 Halogenatome.
Anschließend wird der Chlor-,Chlor-Acetal mit 2 Equivalenten Phosphan zum Wittig-Reagenz umgesetzt.
Hierbei entsteht bei der Umsetzung des Cl-,Cl-Acetales mit 1 eq. Phosphan ein Carben als Zwischenprodukt.
Das Carben reagiert unter Addition eines weiteren Equivalentes Phosphan zum Alkylidenphosphoran, dem Wittig-Reagenz.
Mechanismus:
Annahmen
1. Schritt (SN2-Reaktion am Cl-Atom)
Das Phosphan greift mit seinem freien Elektronenpaar an eines der beiden Chloratome des Cl-,Cl-Acetals an.
Als Abgangsgruppe(Austrittsgruppe)(Nucleofug) fungiert das Carbanion mit einem Cl-Atom, freiem Elektronenpaar, 1 H-Atom und dem Phenylrest.
Als Kation(Gegenion) ist zunächst das Triphenyl-Chlor-Phosphoniumion entstanden.
2. Schritt, Alpha-Eliminierung
Das Carbanion eliminiert (alpha-Eliminierung, α-Eliminierung) ein Chloridion. Dadurch entsteht ein Carben. Das abgespaltene Chloridion wird vom Chlor-Triphenyl-Phosphoniumion aufgenommen, dabei entsteht das Triphenyl-dichlor-Phosphoran mit 5bindigen Phosphor.
Das Carben hat eine Elektronenpaar-Lücke (Elektronen-Sextett am Kohlenstoff-Zentrum) und ein freies Elektronenpaar. Es ist ein Elektrophil und gleichzeitig ein Nucleophil.
3. Schritt Addition Carben und Phosphan
Das Carben addiert an das freie Elektronenpaar des 2. Equivalentes Phosphan und stellt sein vormals freies Elektronenpaar der pπ-dπ-Bindung(Rückbindung) zu Verfügung.
Die Hinbindung kommt vom Elektronenpaar des Phosphans die Rückbindung vom Elektronenpaar des Carbens.
Bei der Rückbindung überlappt das freie Elektronenpaar vom Carben, es ist im 2p-Atom-Orbital, mit einem leeren 3d-Atom-Orbital des Phosphoratoms.
Skizze
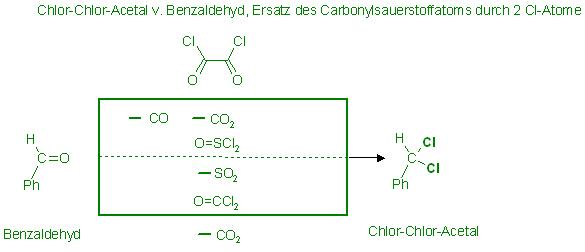
Erzeugung des Chlor-,Chlor.Acetals
Den Aldehyd durch Austausch(Dismutierung) des Carbonylsauerstoffatoms gegen 2 Chloratome in den entsprechenden Chlor-,Chlor-Acetal überführen.
Das geschieht mit sog. "Chlorierungmitteln". Es sind u.a. Phosgen(O=CCl2), dieses wird im Überschuß eingesetzt, ist auch neben der Giftigkeit, schwer zu handhaben.
Besser sind die ebenfalls gefährlichen aber flüssigen Chlorierungsmittel wie das Oxalsäurechlorid(Oxalylchlorid),Cl-(C=O)-(C=O)-Cl und Thionychlorid(Schwefligsäurechlorid), O=SCl2.
Diese nehmen den Carbonylsauerstoff des Aldehydes auf und geben 2 Chloratome ab.
Es entstehen die Dismutierungsprodukte: CO2 beim Phosgen, CO und CO2 beim Oxalylchlorid, SO2 beim Thionylchlorid.
PhCH=O + Cl-(C=O)-(C=O)-Cl → Ph-CHCl2 + IC≡O(g) ↑ + CO2(g) ↑
PhCH=O + O=SCl2 → Ph-CHCl2 + SO2 ↑
Skizze
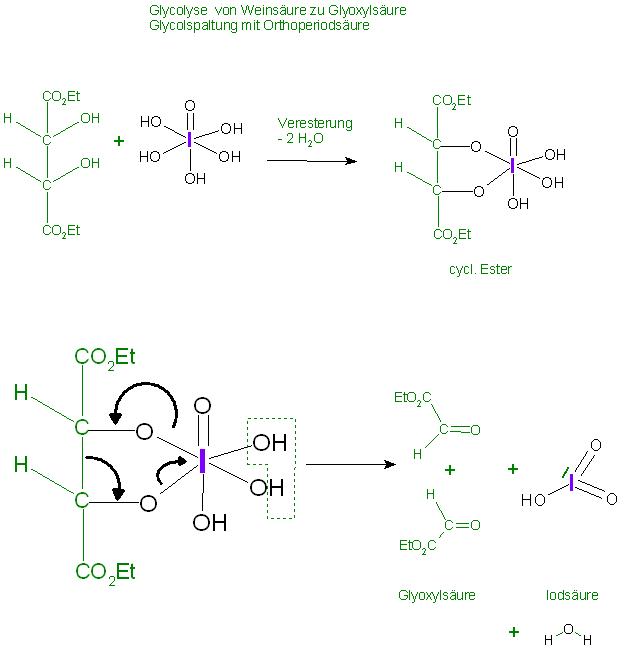
Herstellung der Glyoxylsäure
a). Ozonolyse von Fumar- oder Maleinsäure-ester
b). Glycolspaltung(Glycolyse) von Weinsäure-ester mit Orthoperiodsäure
Skizze