Gruß chemweazle,
Warum ist Anilin eine schwächere Base als Ammoniak?
Erläutern Sie anhand von Grenzformeln, warum Anilien eine schwächere Base als Ammoniak isz.(pkB(C6H5 NH2)=9,37; pkB(NH3)=4.75
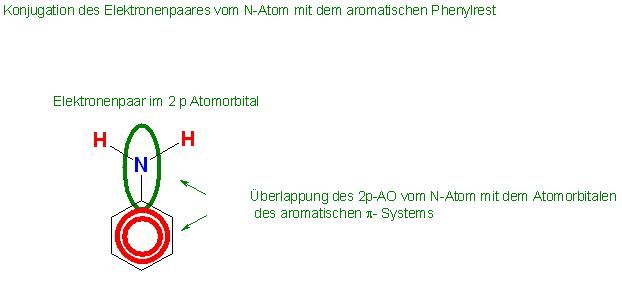
Das Elektronenpaar am Stickstoffatom des Anilins ist nicht so ganz frei. Es wechselwirkt mit den Phenylrest. Hierbei übt das Elektronenpaar vom N-Atom einen + M-Effekt auf das Elektronensystem des Phenylrestes aus.
Das nicht mehr so freie Elektronenpaar am N-Atom des Anilins konjugiert mit dem pi-System-Elektronen des aromatischen Phenyrestes.
Man kann die Bindungswinkel der H-N-H-Bindungen bei der Aminogruppe im Anilin am besten mit einer sp2-Hybridisierung der Atomorbitale am Stickstoffatom erklären.
Das Elektronenpaar am N-Atom besetzt ein 2p-Atomorbital, die beiden N-H-Bindungsmolekülorbitale kann man sich durch die Überlappung aus jeweils einem sp2-Orbital und jeweils dem 1s-AO von einem H-Atom entstanden denken.
Die sigma-Bindung zwischen dem C-Atom und dem N-Atom kann man sich durch Überlappung zweier sp2-Hybridorbitale, 1 vom Phenylrest plus 1 vom N-Atom herstammend, denken.
Konjugation mit dem pi-System
Das 2p-Atomorbital des N-Atoms überlappt mit den 6 2p-Atomorbitalen des Phenyrestes.
Dadruch verringert sich die Basizität der Aminogruppe im Anilin gegenüber Alkylaminen.
Beim Ammoniak und bei Alkylaminen ist das Elektronenpaar am N-Atom freier und kann somit besser gegenüber Brönstedt-Säuren bzw. Lewis-Säuren als Brönstedt-Base bzw. auch als Lewis-Base fungieren.
Wenn das Anilin für Säure-Base-Reaktionen das Elektronenpaar am N-Atom zur Verfügung stellt, geht das auf Kosten der Konjugation mit dem pi-System.
Skizze
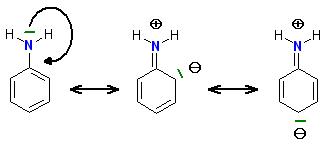
Skizze