Gruß chemweazle,
Zu dem Multiple choice-Fragebogen zur Titration einer starken Säure(HCl-Lsg.), [HCl]0= 0,1 mol / l, mit der Maßlösung, starke Base NaOH, [NaOH] = 0,1 mol / l.
Diagramm
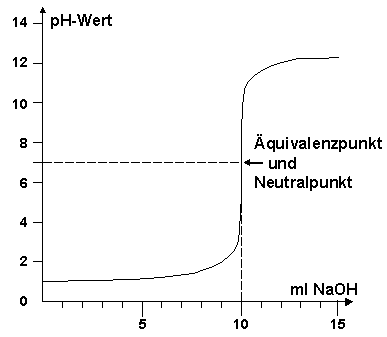
Welche der beiden Aussagen ist oder sind richtig?
1-Um einen neutralen ph-Wert zu erreichen, müssen 10 ml NaOH zugegeben werden.
2- Die Zugabe von 1 ml NaOH kann den ph-Wert um mehr als das Vierfache ansteigen lassen .
(A) Nur Aussage 1 ist richtig
Nur Aussage 1 ist richtig ×, Hier ankreuzen!
Die Aussage 2 ist falsch. Denn der pH-Wert, vom Anfangswert her 1, (pH = 1 ), ändert sich erst im Intervall zwischen 5-10 ml an zugebener Maßlösung sprunghaft. Bei der Zugabe von nur einem ( 1 ml ) NaOH-Maßlösung bleibt er quasi konstant. ( siehe Diagramm)
(B) Nur Aussage 2 ist richtig, völlig falsch, nur Aussage 1 ist richtig
(C) Beide Aussagen sind richtig, nein nur Aussage Nr. 1, Aussage 2 ist falsch
(D) Keine der beiden Aussagen ist richtig, völlig falsch, denn Aussage 1 ist richtig
Die pH-Wert-Änderung bei der Zugabe von einem ml der der NaOH-Maßlösung, das sind 0,1 mmol an NaOH, ΔpH beträgt: ΔpH = 0,09 und nicht 4.
Titration der starken Säure, Chlorwasserstoffsäure, mit starker Base NaOH-Lsg.
Das Aliquot an zu titrierender verd. HCl-Lösung beträgt 10 ml. Der Anfangs-pH-Wert beträgt 1.
Daraus folgt für die Konzentration der H(+)-Ionen, diese entspricht der Einwaagekonzentration an HCl-Molekülen, [H(+)] = [HCl]0
= 10-pH * mol / l = 10-1 mol / l = 0,1 mol / l.
Die vorgelegte Stoffmenge an Chlorwasserstoff, n(HCl) = [HCl]0 * V(Aliquot) = ( 0,1 mmol / ml ) * 10 ml = 1 mmol
Das ist auch die Stoffmenge an H(+)-Ionen vor der NaOH-Zugabe.
Die Konzentration der NaOH-Maßlösung ist ebenfalls gleich groß der HCl-Lsg., [NaOH] = [HCl]0.
Denn bis zum Äquivalenzpunkt, bei der Titration einer starken Säure mit starker Base ist es auch der Neutralpunkt, werden 10 ml NaOH-Maßlösung verbraucht.
Gibt man zu 10 ml der Salzsäurelösung 1 ml der NaOH-Maßlösung, [NaOH] = 0,1 mol / l, hinzu, so verringert sich die Stoffmenge an H(+)-Ionen um 0,1 mmol.
n(H(+)) = 1 mmol - n(NaOH) = 1 mmol - { [ 0,1 mmol / ml ] * 1 ml } = ( 1 -0,1 ) mmol = 0,9 mmol
Nach der Zugabe von 1 ml NaOH-Maßlösung liegen nur noch 9 mmol = n(H(+)) in einem Volumen von 11 ml Lösung vor.
Die Konzentration der H(+)-Ionen beträgt nach der Zugabe von einem ml NaOH-Maßlösung:
$$[H^{(+)} = \frac{0,9\cdot mmol}{11\cdot ml} = \frac{0,9}{11}\cdot \frac{mol}{l} \approx 0,082 \cdot \frac{mol}{l}$$
$$pH = - log-{10}\left(0,082\cdot \frac{mol}{l}\cdot \frac{l}{mol}\right) \approx 1,09$$
Der pH-Wert ändert sich nach Zugabe von 1 ml NaOH-Maßlösung vom Anfagswert 1 zum Wert von 1,09.
Die Änderung des pH-Wertes, ΔpH, beträgt nur: &DElta;pH = 1,09 - 1 = 0,09.