Grüße chemweazle,
Warum reagieren Kohlendioxid und Wasser miteinander wenn sie beide schon Edelgas Konfiguration erreicht haben?
Beispiel:
Wasser und Kohlenstoffdioxid reagieren zusammen zu Kohlensäure. (Chemisches Gleichgewicht)
H2O + CO2(aq) ⇌ H2CO3(aq)
Auch wenn das Gleichgewicht stark auf der Seite der Edukte lastet, wieso reagieren die Reaktionspartner überhaupt miteinander? Alle Atome haben doch schon Edelgaskonfiguration erreicht oder nicht?
Die Lage des Gleichgewichtes der Wasseraddition an das Kohlendioxid, das "Kohlensäure-Anhydrid", liegt links, d.h. auf der Seite der Edukte.
Frage: Warum liegt das Gleichgewicht der Wasser-Addition an CO2 links?
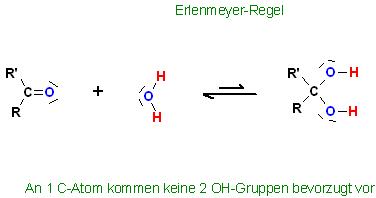
• Antwort: Die Erlenmeyer-Regel besagt, daß 2 OH-Gruppen an 1 C-Atom nicht begünstigt sind.
Skizze
Text erkannt:
Erlenmeyer-Regel
An 1 C-Atom kommen keine 2 OH-Gruppen bevorzugt vor
• Energiearme(stabile) Verbindungen
Unter Energie wird hier die Gesamtenergie der Elektronen pro Molekül betrachtet, das ist die Kinetische und die potentielle Energie aller im Molekül befindlichen Elektronen.
Es gibt Moleküle die energiereicher sind und energieärmere, sog. stabilere Moleküle.
Nun zählen das Kohlendioxid und das Wasser schon zu den recht energiearmen(stabilen) Teilchensorten.
Bei allen Verbrennungsvorgängen mit großer Energiefreisetzung(Verbrennungsenthalpie) enstehen Wasser und CO2(g) als wesentlich energieärmere Reaktionsrodukte(Verbrennungsprodukte).
Im Wassermolekül haben alle Atome Edelgaskonfiguration, der Wasserstoff hat sein Elektronenpaar, das Duett und somit die Edelgaskonfiguration des Heliums. Der Sauerstoff hat die Neonkonfiguration, sein Oktett im Wasser.
Wasser hat 2 sehr polare, energiearme Bindungen.
Das Kohlendioxid ist bekanntlich, zweifellos eine sehr energiearme Verbindung.
Alle Atome erfüllen die Oktett-Regel und es liegen energiearme, polare Bindungen vor.
Was kann da noch an Energiefreisetzung (Reaktionsenthalpieabgabe) gehen?
Nun hat das CO2-Molekül 2 Doppelbindungen, O=C=O. Es sind gehäufte(cumulierte) Doppelbindungen.
Bei Verbindungen mit Cumulierten Doppelbindungen besitzt mindestens 1 Atom 2 Doppelbindungen.
Bei noch energieärmeren Verbindungen befindet sich pro Atom höchtens 1 Doppelbindung.
Andere Beispiele:
Methyl-Allen: CH3-CH=C=CH2, energiereicher, als Butadien: CH2=CH-CH=CH2 mit konjugierten Doppelbindungen, energieärmer.
Im energieärmeren(stabileren) Butadien geht höchstens nur 1 Doppelbindung von 1 C-Atom aus.
Das Methyl-Allen lagert sich deshalb("gerne") in das energieärmere Butadien um.
Warum sind jeweils ein Paar von CO2-Molekülen und Wassermoleküle energiereicher, als ein Kohlensäuremolekül in der undissoziierten Form?
Bei der Kohlensäure liegen nur eine polare C-O-Doppelbindung zwischen 2 Atomen (C=O), insgesamt aber 3 polare Kohlenstoff-Sauerstoffbindungen (O=C(O)2), das sind die C-O-Doppelbindung + die 2 C-O-Einfachbindungen, plus 2 polare, energiearme O-H-Bindungen vor.
O=C(-O-H)2
Somit ist das Kohlensäure-Molekül energieärmer, als jeweils 1 H2O plus ein CO2-Molekül.
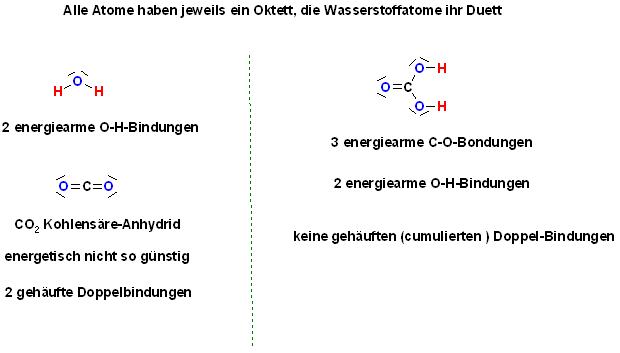
Skizze
Text erkannt:
Alle Atome haben jeweils ein Oktett, die Wasserstoffatome ihr Duett
\( \mathrm{H}^{-\mathrm{O}} \mathrm{H} \)
2 ener giearme O-H-Bindungen
\( 0=c=0 \)
\( a=c_{1}^{\prime} 0-H \)
\( \mathrm{CO}_{2} \) Kohlensäre-Anhydrid energetisch nicht so günstig
2 ener giearme O-HBindungen
2 gehäufte Doppelbindungen
keine gehäuften (cumulierten) Doppel-Bindungen