Gruß chemweazle,
ZU
Wasser reagiert als Säure und Na2O als Base?
Vergleiche die Reaktion von Natrium mit Wasser mit der Reaktion von Natriumoxid mit Wasser unter Verwendung eines passenden Basiskonzept
Bei der Reaktion von Natrium mit Wasser handelt es sich um eine Redoxreaktion und es entstehen 2NaOH und H2(g). Die Erklärung kann ich auch.
Das ist schon mal viel wert und gut.
Bei der Reaktion von Natriumoxid mit Wasser handelt es sich um eine Protolyse, habe ich recht ( das ist meine Vermutung).
Wasser reagiert als Säure und Na2O als Base? Steht dann am Ende OH- und 2 NaOH? Könnten Sie mir bei der letzten Reaktion helfen?
Es ist eine Säure-Base-Reaktion.
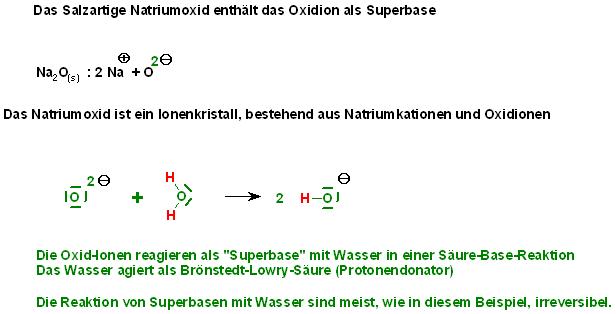
Das Natriumoxid ist eine ionische Verbindung, bestehend aus den Kationen: Natriumionen (Na⊕ ) und den
Oxidionen ( O2⊖ ).
Die Oxidionen ( O2⊖ )sind sogar wesentlich stärker basisch, als die Hydroxidionen ( OH⊖ ).
O2⊖ + H2O → 2 OH⊖
Es sind Superbasen wie das Nitridion, (N3⊖ ), Natriumamid, (NaNH2 ), Butyl-Lithium( C4H9-Li ), Natriumethanolat( NaOC2H5).
Superbasen deprotonieren die Wassermoleküle vollständig. Es gibt keine Umkehrreaktion.
Na2(s, Kristall) + H-O-H → 2 Na⊕(aq) + 2 O-H(⊖(aq)
Das Wasser wirkt als Bröstedt-Lowry-Säure, als Protonendonator.
Skizze