Gruß chemweazle,
es ist ein Alanin-Alaninat-Puffer. Du hast richtig gerechnet.
Der pKs2-Wert von 9,9 ist der pKs-Wert,der sich auf das Alanin selbst bezieht, das in Zwitterionen im Kristallgitter und auch in dieser Zwitterionen-Form in waßriger Lösung überwiegend vorliegt.
Was bedeutet der angegebene pKs1-Wert von 2,4 ?
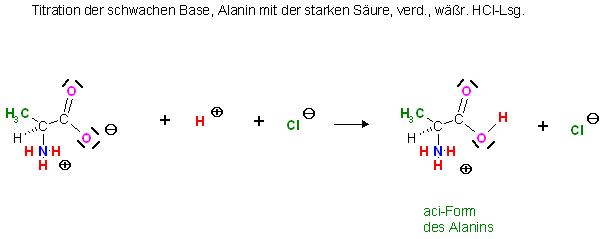
Dieser pKs-Wert bezieht sich auf die sog. "aci-Form" , die mit einer starken Säure protonierte Form der Aminosäure. Es ist formal auch das Alanin-Hydrochlorid.
Dieser pKs-Wert bezieht sich nicht auf das Alanin in Zwitterionen-Form.
Aminosäuren liegen im Kristallgitter als Zwitterionen vor, auch in wäßriger Lösung liegen Aminosäuren überwiegend als Zwitterionen gelöst vor.
Die Zwitterionen der Aminosäuren haben noch mindestens jeweils eine basische Carboxylat-Gruppe, ( -(C=O)-O(-) ), die noch von starken Säuren protoniert werden kann.
Aci-Form von Alanin: Alanin-hydrochlorid
⊕NH3-CH(CH3)-(C=O)-O-H(+) * Cl(-)
Analog lassen sich die Acetationen einer Natriumacetat- oder Kaliumacetatlösung mit verd, Salzsäurelösung ,starke Säure, protonieren. Dabei entsteht die viel schwächere Essigsäure und Natriumchlorid.
CH3-(C=O)-O(-)(aq) + Na(+)(aq) + H(+)(aq) + Cl(-)(aq) → CH3-(C=O)-OH(aq) + Na(+)(aq) + Cl(-)(aq)
Ganz analog
⊕NH3-CH(CH3)-(C=O)-O-(-) + H(+)(aq) ⇌ ⊕NH3-CH(CH3)-(C=O)-O-H(+) + Cl(-)
Somit lassen sich auch Aminosäuren wie Natriumacetatlösungen mit starken Säuren, HCl-Lsg., HBr-Lsg. oder Perchlorsäurelösung acidimetrisch titrieren. (Titration schwacher Basen mit starken Säuren ).
Skizze
Text erkannt:
Titration der schwachen Base, Alanin mit der starken Säure, verd., wäßr. HCl-Lsg.