Aufgabe:
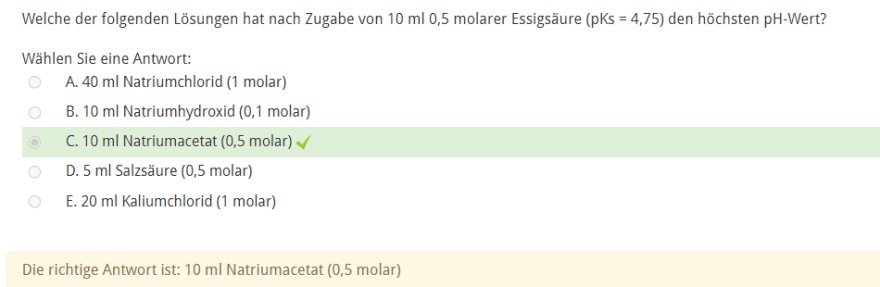
Problem/Ansatz:
Da bei einem Puffer der pH-Wert nur dann maximal ist, wenn das Verhältnis von der Konzentration der Säure und Base gleich 1 ist, würde man nach der Lösung suchen, der mit der Essigsäure ein Verhältnis von 1 haben wird.
Die Stoffmenge der Essigsäure beträgt : 10^-2 * 5 * 10^-1 = 5 * 10^-3 mol
Die gleiche Stoffmenge hätte hier Natriumacetat. Diese Lösung würde sich also anbieten.
Könnte man nun auch die vierte Variante wählen, wenn statt Salzsäure Natriumhydroxid stehen würde ?
Denn dann würden durch die 5ml NaOH mit der Konzentration 0,5 (n= 5 * 10^-3 * 5 * 10^-1 = 2,5 * 10^-3 mol) 2,5 * 10^-3 mol Essigsäure zu Acetat deprotoniert werden. Übrig bleiben dann 2,5 * 10^-3 mol Essigsäure. S hätte man auch ein Verhältnis von 1 und der pH-Wert wäre auch maximal.
Ist es so richtig? :D)
Danke im Voraus