Salut marya,
Warum die einzelnen Kationen stets jeweils die exakt gleiche Flammenfärbung zeigen ?
In einer farblosen Flamme geben Elemente / Ionen für uns sichtbares Licht ganz bestimmter Wellenlängen ab, die unverwechselbar und charakteristisch sind. Kleine Wellenlängen nehmen wir wahr als violett oder blau, größere Wellenlängen als gelb oder rot.
Als Beispiele folgende Kationen:
Na+ → Spektrum von 589 nm → gelbe Flammenfärbung
Cs+ → Spektrum von 459 nm → violette Flammenfärbung
Li+ → Spektrum von 671 nm → rote Flammenfärbung
°°°°°°°
Ausschnitt aus dem sichtbaren Spektrum, Wellenlänge in nm
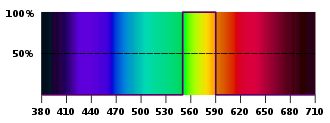
(Quelle: Wikipedia)
Kurze Erklärung: Durch die Hitze einer farblosen Flamme werden die Valenzelektronen auf ein vom Atomkern weiter entferntes Energieniveau, also in einen angeregten Zustand angehoben, fallen aber blitzartig wieder zurück auf ein energieärmeres Energieniveau. Dabei wird Wärmeenergie in Strahlungsenergie umgewandelt, also ein Lichtteilchen (Photon) abgegeben. Die freigegebene Lichtenergie ist nun immer abhängig von der Differenz der Energieniveaus, die für jedes Element unterschiedlich ist. Letztlich bestimmt damit die Energie der Photonen die Wellenlänge und damit die spezifische Flammenfärbung.
Ich hoffe, das bringt dich weiter :)