Grüße chemweazle,
Zu
Aufgabe: Mesomere Effekte der Hydroxybenzoesäure
Problem/Ansatz: Ich verstehe nicht wieso bei m-hydroxybenzoesäure keine mesomeren Grenzstrukturen entstehen können, während bei der OH Gruppe in p und o Stellung +M Effekte wirken. Kann das jemand erklären?
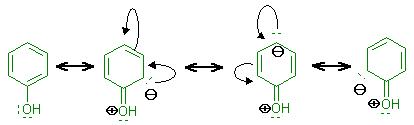
Ein Elektronenpaar-Donator(Donor) erhöht am Benzenring die Ladung in ortho- und in para-Position.
(siehe Skizze mit Phenol)
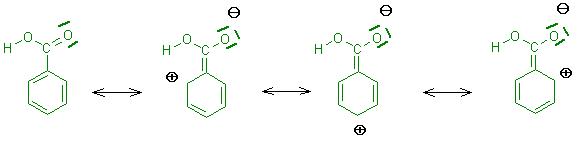
Ein Elektronenpaar-Acceptor verringert die Ladung, bzw. erzeugt in den Grenzformeln postive Ladungen, in den beiden ortho-Positionen und in der para-Position des 6-Rings am Benzen-Gerüst.
(siehe Skizze Benzoësäure)
Das hat zur Folge, daß die Ladungsabnahme(positive Ladungen in den para und ortho-Positionen) bedingt durch den Acceptor durch den Donor ausgeglichen wird.
Dies trifft für die ortho-Hydroxybenzoësäure(Salicylsäure) und für die para-Hydroxybenzoësäure zu.
Es finden sich in den Grenzformeln auch welche, bei denen der 6gliedrige Benzenring keine Ladungen an den C-Gerüstatomen trägt.
(siehe Skizzen zur ortho-Hydroxybenzoësäure und para-Hydroxybenzoësäure)
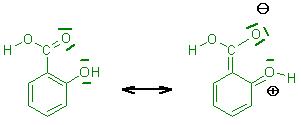
o-Hydroxy-Benzoesäure(Salicylsäure)-Grenzformeln.JPG
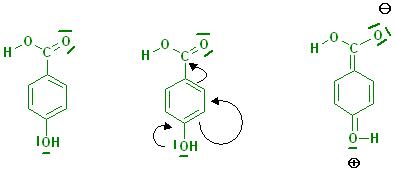
p-Hydroxy-Benzoesäure-Grenzformeln.JPG
Elektronenpaar-Acceptor und der Donor in meta- Postion zueinander
(siehe Skizze der Grenzformeln der meta-Benzoësäure)
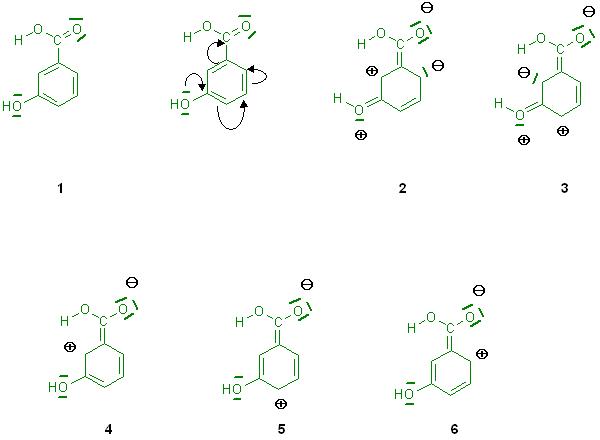
m-Hydroxybenzoesäure-Grenzformeln.JPG
Betrachtet man die Grenformeln 2 und 3 der meta-Benzoësäure bei denen die OH-Gruppe als Elektronenpaar-Donor agiert, so treten sogar bei beiden Grenzformeln 2 positive und 2 negative Ladungen auf.
Grenzformeln dieser Art mit mehr als einer positiven und einer negativen Ladung stellen zu energiereiche Zustände dar. Diese haben kein realistisches Gewicht, sie sind hinfällig.
Die Grenzformeln mit nur 1 positiven und 1 negativen Ladung werden nur unter Ausschluß der Elektronenpaar-Abgabe der OH-Gruppe , also ohne Berücksichtigung der Donorwirkung, zeichnerisch erhalten.
Schlußfolgerung :
Die OH-Gruppe kann in der meta-Stellung den Elektronendichte-Abzug des Acceptors, Carboxylgruppe, COOH-Gruppe, nicht an den Gerüst-Kohlenstoff-Atomen des 6-Rings ausgleichen.
Ein Elektronenpaar-Donator (OH-Gruppe) ist in meta- Position zum Acceptor für den Ladungsausgleich an den Ringatomen des Benzen-6-Rings unwirksam.