Grüße chemweazle,
Zur
Aufgabe:
Beschreiben Sie die Elektronenstruktur von Übergangsmetall-Carbonyl-Komplexen! Welche M-CO-Wechselwirkungen (Bindungsanteile) sind zu berücksichtigen (Skizze)? Schätzen Sie deren Beiträge zur M-CO-Bindung in neutralen Metallcarbonylen ab!
Irgendwie verstehe ich die ganze Aufgabe von Grund auf nicht ganz. Ich tu mir extrem schwer die Begriffe zu verstehen.
Doch, Du hast sie doch schon in Worten beantwortet.
Meine Idee wäre die Orbitale der sigma-Hinbindung und pi-Rückbindung zu skizzieren, wobei bei der sigma-Bindung ein Elektronenpaar vom Kohlenstoff zum Metall geschoben wird und bei der pi-Bindung ein Elektronenpaar vom Metall ins leere Orbital des Kohlenstoffs.
Richtig, das Dewar-Chatt-Duncanson-Modell, der CO-LIgand ist ein σ-Donor-, π-Acceptor-Ligand, wie auch die Phosphane als Liganden.
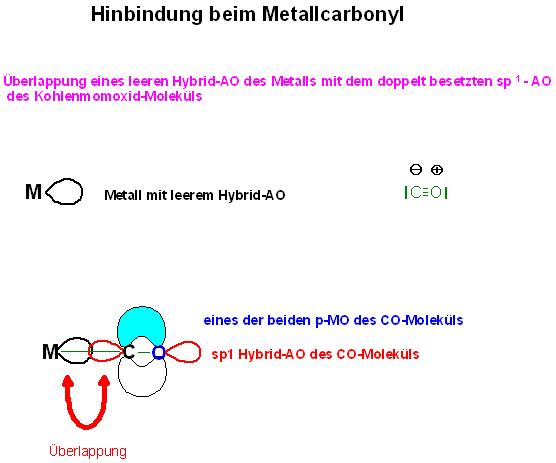
Hin-Bindung
Man denkt sich znächst nach dem VB-Modell leere Hybrid-Atomorbitale der äußersten Schalen überlappt mit dem sp1-Orbital des Freien Elektronenpaars des Kohlenstoffs des CO-Liganden.
Beim tetraedrischen Nickeltetracarbonyl überlappen jeweils die leeren 4 sp3-Orbitale mit jeweils einem freien Elektronenpaar eines CO-Liganden.
Das sind die 4 Hinbindungen beim Ni(CO)4-Tetracarbonyl.
Beim trigonalbipyramidalen Eisenpentacarbonyl, Fe(CO)5, sind es leere 4sp3d2-Hybridorbitale, die jeweils mit dem freien Elektronenpaar eines der 5 CO-Liganden überlappen.
Das sind die 5 Hin-Bindungen der 5 CO-Liganden zum Eisenatom.
Rückbindung, Backdonation
Nun wird ein Sprung vom VB-Modell zur MO-Theorie gemacht. Jetzt werden vom CO-Molekül die antibindenden π*-Molekül-Orbitale des CO-Moleküls betrachtet.
Die leeren antibindenden pi-CO-Molekül-Orbitale sind symmetriepassend zu einigen vollbesetzten Atom-Orbitale des Metallzentrums.
Skizzen
Ich weiß, dass je stärker die M-C Bindung, desto schwächer die C=O Bindung ist. Und ich weiß, dass je stärker die Liganden am Metall pi-Akzeptoren sind, desto stärker ist die M-C Bindung.
Ganz genau, das zeigt im Vergleich der neutralen Metallcarbonylverbindungen mit ihren Metallaten.
IR-spektroskopisch zeigt sich deutlich eine Abnahme der CO-Strechschwingswellenzahl bei stärkerer Metall-Kohlenstoff-Bindung.(M-C-Bindung)
Beim Eisenpentacarbonyl, Fe(CO)5, tbp(trigonal-bipyramidal) ist die CO-Streckfrequenz größer, als beim Fe(CO)4(2-), dem Anion aus dem Collman´s-Reagenz, Na2Fe(CO)4 * 1,5 Dioxan.
Bei den neutralen Metallcarbonylen ähneln die CO-Streckfrequenzen den C-Dreifach-Bindungs-Streckschwingungen der Alkine und Nitrile, ν(C≡N) und ν(C≡CH), bei den Metallaten mit den stärkren Metall-C-Bindungen hingegen entsprechen die CO-Streckschwingungs-Frequenzen mehr den Doppelbindungs-Streckschwingungen, ν(C=O) der Ketone und Aldehyde.