Grüße chemweazle,
Zeichnen Sie die Skelettformeln von :
n-Butansäure
CH3–CH2–CH2–(C=O)-O-H
pKs = 4,82
2-Hydroxybutansäure
pKs = 3,65
CH3–CH2–CH(OH)–(C=O)-O-H
pKs = 3,65
3-Hydroxybutansäure
pKs = 4,70
CH3–CH(OH)–CH2–(C=O)-O-H
n-Octansäure
CH3–(CH2)6–(C=O)-O-H
pKs = 4,89
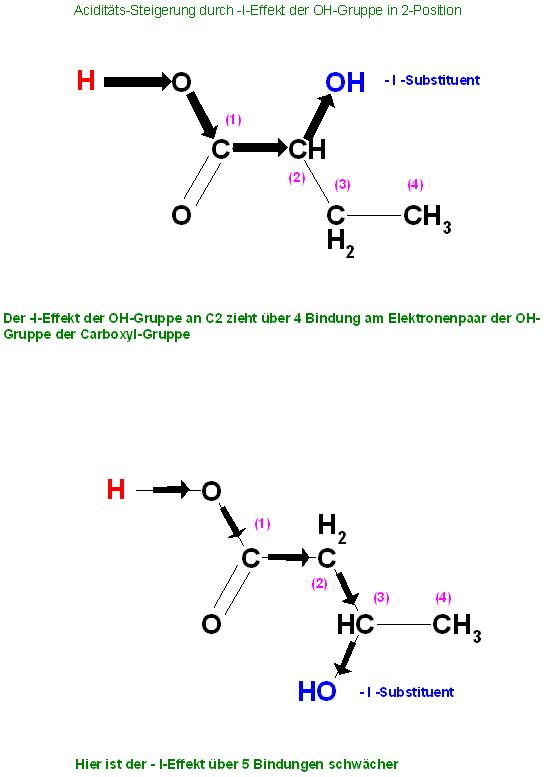
Erklärung 2-substituierte Carbonsäuren mit Substituenten hoher Elektronegativität, die einen "Negativen Induktiven Effekt" { - I-Effekt } ausüben, besitzen eine höhere Säurestärke.
Das sind z.B.: Chloressigsäure, 2-Chlor- , 2- Hydroxy- , 2-Fluor- Propansäuren bzw. –Butansäuren.
Der Negative Induktive Effekt , augeübt durch einen elektronegativen SubstituentenDer Elektronegative Substituent zieht am Elektronenpaar der Einfachbindung. Dadurch wird das unmittelbar benachbarte C-Atom leicht positiv polarisiert und somit das übernächste und weitere C-Atome.
Die OH-Gruppe am C(2)- Atom zieht somit über 4 Bindungen am Elektronenpaar der O-H-Gruppe der Carboxylgruppe der Carbonsäure und erleichtert somit die Dissoziation in Proton und Säure-Rest ( Carboxylation, konjugierte Base ).
Befindet sich der –I-Effekt ausübende, am Elektronenpaar ziehende, Substituent nicht in 2-Position zur Carboxylgruppe, sondern in 3-Position oder 4-Position, so läßt der sog. "Negative-Induktive-Effekt auf die OH-Gruppe der Carboxyl-Gruppe der betreffenden Carbonsäure erheblich nach.
Das heißt,der Effekt wird über eine sehr große Anzahl an Bindungen zuehmend abgeschwächt.
Deshalb wirkt sich dieser Effekt bei der 3-Hydroxybutansäure kaum noch spürbar aus. Die Acidität ist nicht mehr deutlich stärker, als bei gewöhnlich unsubstituierten Carbonsäuren, wie z.B. die Butansäure.
siehe Skizze
Text erkannt:
Aciditäts-Steigenung durch-I-Effekt der OH-Gruppe in 2-Position
Der -I-Effekt der OH-Gruppe an \( \mathrm{C} 2 \) zieht über 4 Bindung am Elektronenpaar der \( \mathrm{OH} \) Gruppe der Carboxyl-Gruppe
Hier ist der - I-Effekt über 5 Bindungen schwächer