Grüße chemweazle,
β-Eliminierung am Bromalkan
Dehydrohalogenierung mit Alkohholaten als Basen, Natriumethanolat und Natrium-tert.-Butanolat an einem Bromalkanderivat
Edukt : Bromalkan, ein verzweigtes Bromhexanisomer , 2-Brom-2,3-dimethylbutan
Skizze
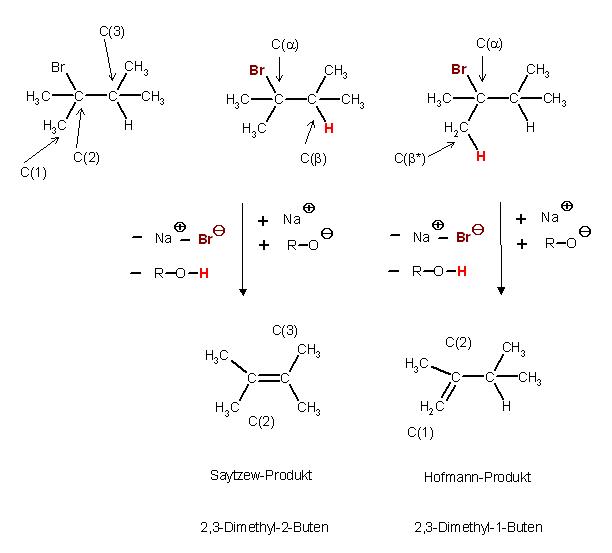
Es sind 2 β-Eliminierungen möglich.
Das C-Atom Nr. 2 besitzt das Bromatom, die Abgangsgruppe, Austrittsgruppe, auch Nucleofug genannt. Man kann es als das α-C-Atom zusätzlich bezeichnen. Das Bromatom(Halogenatom) wird auch somit alpha-ständig genannt.
Dem C-Atom Nr. 2 sind sowohl das C-Atom Nr. 3 mit und das C-Atom Nr. 1 mit jeweils mindestens einem H-Atom benachbart.
Man könnte das C-Atom Nr. 3 als β-Atom bezeichnen und entsprechend das C-Atom Nr. 1 als β*-Atom benennen.
Bei einer der Eliminierungen entsteht die Doppelbindung zwischen den beiden C-Atomen Nr. 2 und Nr. 3, wenn das &beta-ständige H-Atom und das α-ständige Bromatom abgespalten werden.
Analog könnten auch das beta * - ständige H-Atom am C-Atom Nr. 1 und das Bromatom am C-Atom Nr. 2 abgespalten werden, dann entsteht die Doppelbindung zwischen den beiden Kohlenstoffatomen Nr.1 und Nr.2.
Produkte der Eliminierungsreaktion und deren Namen
Olefin 1 : Saytzew-Produkt, 2,3-Dimethyl-2-Buten oder
2,3-Dimethyl-but-2-en
C(1)H3–C(2)(CH3)=C(3)(CH3)2
Olefin 2 : Hofmann-Produkt, 2,3-Dimethyl-1-Buten oder 2,3-Dimethyl-But-1-en
C(1)H2=C(2)(CH3)–C(3)H(CH3)2
Reaktionsmechanismus
Skizze
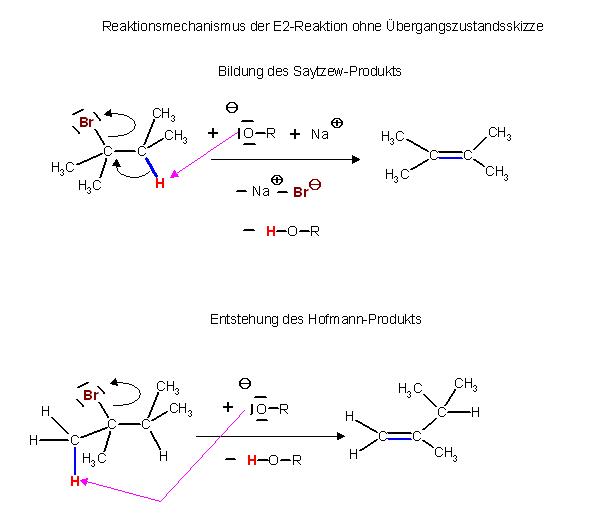
Produktverteilung bei Verwendung unterschiedlicher Basen
Bei der Verwendung von Natrium-ethanolat wird das energetisch günstigere Saytzew-Produkt, hier im Text mit Olefin 1 bezeichnet, überwiegen.
Es ist das 2,3-dimethyl-2-buten.
Base : Na (+) * (-)O-CH2-CH3
Bei der sterisch anspruchsvolen Base , Natrium-tert. Butanolat hingegen überwiegt das energetisch ungünstigere Hofmann-Produkt.
Es ist das Konstitutinsisomer, Olefin 2 hier im Text, das 2,3-Dimethyl-1-Buten.
Base : Na (+) * (-)O-C(CH3)3
Das tert.-Butanolation ist sterisch sehr anspruchsvoll, es hat den voluminösen Tert-Butylrest mit 3 Methylgruppen am Alkoholat-C-Atom, deshalb erfolgt ein Angriff pro Volumen und Zeit häufiger aus räumlichen Gründen an der außen gelegenen Methylgruppe, das ist das Kohlenstoffatom Nr. C(1).
Generell greifen sterisch anspruchsvolle Basen schneller, häufiger pro Zeit, an den äußeren Enden eines Moleküls an, als in den durch Methylgruppen abgeschirmten mittleren Molekül-Teilen.
Um an ein sterisch abgeschirmten Teil anzugreifen, muß die Base ganz heftig mit dem Molekül zusammenstoßen, solche heftige Molekülzusammenstöße geschehen aber pro Zeiteinheit seltener.
Das Ethanolation hingegen ist durch den kleinen Ethylrest wesentlich kleiner, räumlich nicht so anspruchsvoll, kann auch sehr häufig sowohl am H-Atom von C-Atom Nr.1 und am H-Atom an C-Atom Nr. 3 gleichermaßen gut angreifen.
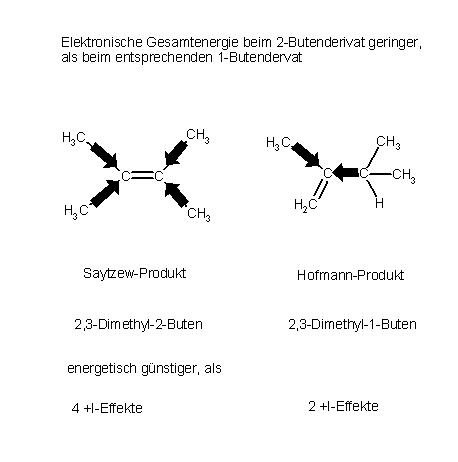
Die beiden Produkte im Vergleich, Saytzew- und Hofmann-Eliminierungsprodukt
Energetisch günstiger ist jedoch das Olefin 1 mit der Doppelbindung an C(2), also das Saytzew-Produkt, 2,3-Dimethyl-2-Buten. Die Gesamtenergie der Elektronen ist hier geringer, als beim konstitutionsisomeren Hoffmann-Produkt, dem 2,3-Dimethyl-1-Buten.
Ursache ist die Stabilisierung durch die Induktiven Effekte(+I-Effekt). Die Doppelbindung im 2-Butenderivat erhält 4 + I-Effekte, beim 1-Butenderivat sind dagegen nur 2 +-Effekte durch die benachbarten Alkylgruppen wirksam.
Skizze