Vielen herzlichen Dank für die Antwort!
Hier noch zwei Gedankengänge zu diesem Beispiel, bitte noch auf Korrektheit überprüfen, bin mir absolut nicht sicher:
- Das ist bei der Stickstoffgruppe in der zweiten Zeile (unten abgebildet) nicht möglich, dass die Doppelbindung auf die Stickstoffgruppe klappt, da ansonsten das gelb markierte Kohlenstoff-Atom zu wenig Außenelektronen hat
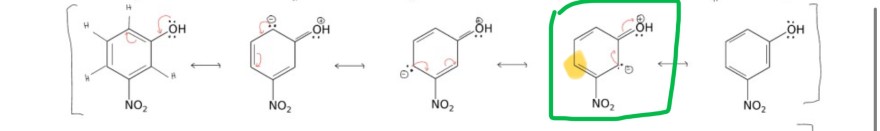
- Also wäre vermutlich schon möglich aber wir würden zwei weitere Formalladungen bekommen, was es zu keiner guten Grenzformel macht … weshalb sie auch nicht gezeichnet werden muss.
Oder welchen Grund gibt es dafür?
Stimmt das?
Danke für eure Hilfe!
Und ich entschuldige mich im Voraus, falls ich mich mit etwas „unchemischen Beschreibungen“ ausdrücke. Ich bin neu auf diesem Gebiet :)
Lg Charly