Salut pradolce,
bei Benzol sind auf deinem Bild zwei unterschiedliche Valenzstrichformeln beschrieben. Man bezeichnet sie als mesomere Grenzformeln, was auch durch den Mesomeriepfeil in der Mitte angezeigt wird. Dieser Pfeil weist außerdem darauf hin, dass beide Valenzstrichformeln gleichwertig sind. (Du erkennst, dass sich die Doppelbindungen rechts genau an der Stelle befinden, wo links die Einzelbindungen sind.)
Im Klartext bedeutet das, dass die Bindungsverhältnisse bzw. die Verteilung der Elektronen im Benzolmolekül eben nicht in ausreichender Weise durch eine einzige Formel dargestellt werden können, sondern nur durch mehrere Grenzformeln.
Diese Grenzformeln vermitteln den Eindruck, es würde sich um lokalisierte Elektronen handeln, in Wirklichkeit weiß man aber nicht, wo sie sich genau aufhalten. Letztlich ist nur bekannt, dass sie sich im Ring aufhalten. Die tatsächliche Verteilung der Elektronen befindet sich somit eher zwischen den von den Grenzformeln angezeigten Elektronenverteilungen. Beschreiben lässt sich deshalb das Molekül vielleicht besser als eine gemischte Form dieser beiden Grenzformeln.
Um dem Rechnung zu tragen, kann man das für das Benzol folgendermaßen verdeutlichen:
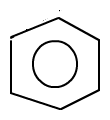
(Quelle: Eigene Grafik)
Durch den Kreis innerhalb des Kohlenstoffrings wird angezeigt, dass ein konjugiertes π-System vorliegt, ohne jedoch den Eindruck zu erzeugen, man wisse Bescheid über die genauen Aufenthaltsorte der Eletronen.
Viele Grüße :)