Hi, heres chemweazle
Beide Moleküle haben nur jeweils eine cyclische Halbacetalgruppe, die nach Ringöffnung, säure- oder basenkatalysiert, jeweils in geringer Gleichgewichtskonzentration die sog. freie Aldehydform liefern,
also auch die Glucose, der Traubenzucker.
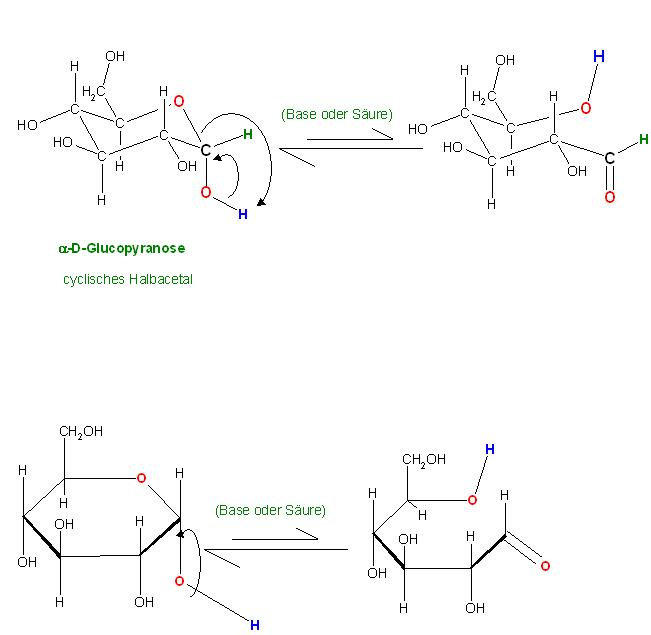
Während der Oxidation mit z.B. Fehlings-Reagenz oder Tollens-Reagenz, der Aldehyde zu den entsprechenden Carboxylaten, wird der verbrauchte Aldehyd durch die Halbacetal-Ringöffnung wieder nachgeliefert.
D.h. zwischen dem cyclischen Halbacetal und der offenkettigen Aldehydform stellt sich ein dynamisches Gleichgewicht ein. Wird Aldehyd aus dem Gleichgewicht durch die Oxidation entfernt, so wird Aldehyd aus der cyclischen Halbacetal nachgeliefert.
Aus der Glucose entsteht durch die Oxidation in alkalischer Lösung das Natriumsalz der Gluconsäure, das Natriumgluconat. Aus der Maltose erhält man das Natriumsalz der Maltobionsäure, das Natriummaltobionat.
Bilder der Gluconsäure und der Maltobionsäure
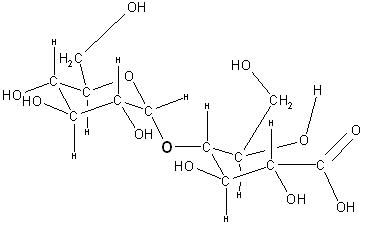
Maltobionsäure
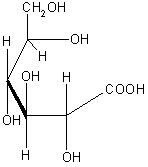
Gluconsäure
1 mol Aldehyd liefert unter Abgabe von 2mol Elektronen an 2 Kupfer(II)-Tatratokomplexeinheiten 1 mol Kupfer(I)Oxid (Cu2O, Cuprit).
Reaktionsgleichungen
R-C(I)H=O + 3OH(-) → R-C(III)O2(-) + 2 e(-) + 2 H2O
2 [Cu(II)(sec. Tartrat)2](2-) + 2 e(-) + 2 OH(-) → Cu(I)2O + H2O + 4 sec. Tartrat(2-)
_________________________________________________________________________________
R-C(I)H=O +
5 OH
(-) +
2 [Cu(II)(sec. Tartrat)
2]
(2-) +
2 e
(-) → R-C(III)O
2(-) + Cu(I)
2O +
3 H
2O +
4 sec. Tartrat
(2-) sec. Tartrat: (-)O2C-(CHOH)-(CHOH)-CO2(-)
Der Grund für die geringere Niederschlagsbildung von Kupfer(I)-Oxid (Cu2O,Cuprit) bei der Fehlingprobe im Falle des Malzzuckers liegt in der geringeren eingesetzten Stoffmenge, der Molzahl. Der Malzzucker hat eine fast doppelt so große Molekülmasse, als Glucose, abzüglich ein H2O.
Setzt manz.B. jeweils 1g der 0,5%igen Lösungen, das ist der Massenanteil, zu einer ausreichenden Menge an Fehling-Reagenz zu, so hat man in beiden Fällen nur 0,005g = 5mg Glucose bzw. Maltose hinzugegeben.
m(Glucose) = m(C6H12O6) = 0,005g= 5mg
m(Maltose) = m(C12H22O11) = 0,005g = 5mg
M(Glucose), M(C6H12O6) = (12,011*6+1,0079*12+15,9994*6)= 180,1572 g/mol
M(Maltose), M(C12H22O11)=(12,011*12+1,0079*22+15,9994*11)= 342,2992 g/mol
n(Glucose) = 5mg * mmol/180,1572mg = 0,0278 mmol
n(Maltose) = 5mg * mmol/342,2992mg = 0,0146 mmol
(5mg, 0,0278 mmol) Traubenzucker liefern maximal 0,0278 mmol Kupfer(I)Oxid.
(5mg, 0,0146 mmol) Malzzucker liefern dagegen nur maximal 0,0146 mmol Kupfer(I)Oxid.
Gruß chemweazle