Hi, here chemweazle,
Eine Mammutaufgabe, stöhn
In einem Labor soll Wasser auf seinen Gehalt an Magnesium,Natrium,Chlorid und Sulfationen untersucht werden. Dabei ist die Menge an Carbonationen zu vernachlässigen.
Für den Überblick eine grobe Beschreibung der Vorgehensweise.
Analyse einer Wasserprobe: Diese Lösung besteht aus den Kationen Natrium und Magnesium und als Anionen sind nur Chlorid und Sulfat anwesend.
Einmal wird die Summe der Kationen bestimmt.
Das geschieht mit dem Kationenaustausch mittels saurem Kationenaustauscher. Hierbei werden die Magnesium- und Natriumionen gegen Protonen fast vollständig ersetzt und anschließend wird die erhaltene, stark saure Lösung acidimetrisch titriert.
Es erfolgt eine Einzelbestimmung von Magnesium.
Mittels der Komplexometrischen Titration mit EDTA als Chelatkomplexbildner wird nur der Magnesiumionengehalt für sich ermittelt.
Der Natriumgehalt wird durch die Differenzbildung ermittelt, indem der Magnesiumgehalt von dem Gesamtkationengehalt, Summe aus Natrium- und Magnesiumkonzentration, subtrahiert wird.
Der Chloridionengehalt wird durch die Argentometrie bestimmt.
DIe Sulfationenkonzentration wird mit der Elektroneutralitätsbedingung; dem Gesetz der Erhaltung der Ladung; errechnet.
Gesamtbest. von Natrium und Magnesium
1.Man lässt 10,00ml Wasser über einen (quantitativen) Kationenaustauscher laufen und titriert die durchgelaufene Flüsssigkeit mit Natronlauge (c=0,500 mol/l) Verbrauch: 11,76ml.
Best. der Natriumionen- und Magnesiumionenkonzentration durch acidimetrische Titration nach vorangegangenen saurem Kationenaustausch
Die Natriumionen werden in der elektrischen Doppelschicht an dem sauren Kationenausstauscher durch jeweils ein H(+)-Ion ersetzt.
Jedes zweifach positiv geladenes, zweiwertiges, Magnesiumion wird durch jeweils 2 Protonen ausgetauscht.
Ionenaustausch, schematisch
Die Magnesiumionen und die Natriumionen werden gegen Protonen ausgetauscht.
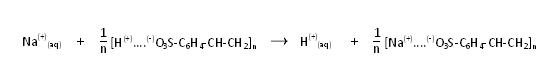
Für den Autausch bei den Natriumionen, gilt: n(Na(+)) = n(H(+))
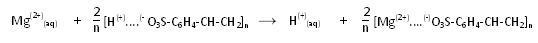
Für den Austausch bei 2wertigen Ionen gilt:
n(H(+)) / n(Mg(2+)) = 2 / 1, daraus folgt: 2 n(Mg(2+)) = n(H(+))
Nun gilt für den Austausch beider Ionen, Natrium- und Magnesiumionen:
n(H(+)) = n(Na(+)) + 2 n(Mg(2+))
Erfassung der Summe der Stoffmengen an Natrium- und Magnesiumionen durch die Best. von n(H(+)) mittels der Säure-Base-Titration
c(NaOH) = 0,5 mol/l = 0,5 mmol/ml
Verbrauch V = V(NaOH) = 11,76ml
(H(+)) = n(NaOH) = c(NaOH) * V(NaOH) = 0,5 (mmol /ml) * 11,76 ml = 5,88 mmol
5,88 mmol = n(Na(+)) + 2 n(Mg(2+))
Diese Gesamtstoffmenge bezieht sich auf 10ml Probenvolumen V.
5,88 mmol / 10ml = n(Na(+)) / V + 2 n(Mg(2+)) / V = 0,588 mmol/ml
Bestimmung der Chloridionenkonzentration, Chloridgehalt mit Hilfe der Argentometrischen Titration nach Mohr
2. 10,00ml Wasser werden auf 100 ml verdünnt. Von dieser Lösung werden 10,00ml mit AgNO3-Lösung (c=0,086 mol/l) nach Mohr titriert. Verbrauch: 6,21ml
V(probe) = 10ml, verdünnt zur Analysenlösung auf 100ml.
Analysenlösung: 100ml im Meßkolben, Aliquot: 10ml mit der Vollpipette entnommen, zur Titration
c(AgNO3) = 0,086 mmol/ml, Verbrauch: V(AgNO3) = 6,21ml
Titration
AgNO3 + Cl(-) → AgCl(s) + NO3(-)
Endpunktanzeige
2 AgNO3 + Cl(-) → Ag2CrO4 (s, orange)
n(Cl(-)) = n(AgNO3) = c(AgNO3) * V(AgNO3)
n(Cl(-)) = 0,086 mmol/ml * 6,21ml = 0,53406 mmol
Das ist die Stoffmenge an Chloridionen in den 10ml Aliquot, welches mit der 10ml Vollpipette aus dem 100ml Meßkolben mit der Analyselösung zur Titration entnommen wurde
Die Konzentration des Aliquotes und der Analyselösung sind gleich.
c(Cl(-)), Aliquot= 0,53406 mmol/10ml = 0,053406 mmol/ml
Die Stoffmenge im 100ml Meßkolben ist auch die Stoffmenge an Chloridionen aus der entnommenen Wasserprobe.
n(Cl(-)) =c(Cl(-)),Aliquot mal 100ml = 0,053406 mmol/ml * 100ml = 5,3406 mmol
Diese Stoffmenge an Chloridionen geteilt durch das Volumen der Wasserprobe, Probenvolumen, mit dem Wert von 10ml ergibt die Chloridionenkonzentration der zu analysierten Wasserprobe.
c(Cl(-)), Wasserprobe = 5,3406 mmol /10ml = 0,53406 mmol/ml = 0,53406 mol/l
Mit der Atommasse(Molmasse) von Chlor:
M(Cl) = 35,453 g/mol, ergibt sich eine Massenkonzentration der Chloridionen cm(Cl(-)):
cm(Cl(-)) = c(Cl(-)) mal M(Cl)
cm(Cl(-)) = 0,53406 mol/l * 35,453 g/mol = 18,934 g/l
Einzelbestimmung der Magnesiumkonzentration mittels Komplexometrie
3. 10,00ml Wasser werden mit einer Indikator Puffertablette versetzt und mit EDTA (c=0,05mol/l. f=1,000 ) titriert. Verbrauch:10,20ml.
Magnesiumgehaltsbestimmung durch Komplexometrie mit EDTA als Komplexbildner und vermutlich Erio-T-Chromschwarz als Farbindikator.
Die hydratisierten Magnesiumionen bilden mit EDTA einen 1zu1-Komplex, es ist auch ein Chelatkomplex.
Titration
Mg(2+)(aq) + EDTA → [Mg(EDTA)](2+)
oder
[Mg(H2O)6](2+) + EDTA → [Mg(EDTA)](2+) + 6 H2O
c(EDTA)= 0,05mol/l = 0,05 mmol/ml
Verbrauch: V(EDTA) = 10,20ml
n(EDTA) =n([Mg(EDTA)](2+)) = n(Mg(2+)(aq))
n(Mg(2+)(aq)) = 0,05 mmol/ml * 10,2ml = 0,51 mmol,
bezogen auf 10ml Probenvolumen
c(Mg(2+)(aq)) = 0,51mmol/10ml = 0,051mmol/ml = 0,051 mol/l
Mit der Atommasse(Molmasse) von Magnesium
M(Mg) = 24,305g/mol
Für die Massenkonzentration von Magnesium cm(Mg(2+)) gilt:
cm(Mg(2+)) = 0,051 mol/l *24,305g/mol = 1,239555 g/l, gerundet 1,24 g/l
Es fehlen noch die Stoffmengen und die Konzentrationen der Natriumionen und der Sulfationen.
Ermittlung der Natriummenge durch Subtraktion der Magnesiumionenkonzentration von der Gesamtkationenkonzentration.
Bei der acidimetrischen Titration des Eluates aus dem sauren Kationenaustauschers gilt:
n(H(+)) = 5,88 mmol = n(Na(+)) + 2 n(Mg(2+))
Es sind die 5,88 mmol Gesamtstoffmenge an Natrium- und Magnesiumkationen in 10ml Probe(Wasserprobe).
In 10 ml Probe sind zusätzlich 0,51mmol Magnesiumionen enthalten.
n(Na(+)) = n(H(+)) – 2n(Mg(2+))
n(Na(+)) = 5,88 mmol – 2* 0,51mmol =(5,88 – 1,02)mmol = 4,86mmol
c(Na(+)) = 4,86mmol/10ml = 0,486 mmol/ml = 0,486 mol/l
Mit der Molmasse von Natrium M(Na) = 22,98977g/mol, ergibt sich eine Massenkonzentration der Natriumionen cm(Na(+)):
cm(Na(+)) = 0,486 mol/l *22,98977g/mol = 11,173 g/l
Es fehlt noch die Sulfationenkonzentration:
Natrium: c= 0,486 mol/l, cm= 11,173 g/l
Magnesium: c= 0,051 mol/l, cm= 1,24 g/l
Chlorid: c= 0,53406 mol/l, cm= 18,934 g/l
Bestimmung der Sulfationenkonzentration mit dem Gesetz der Erhaltung der Ladungseinheiten oder, anders genannt, der Elektroneutralitätsbedingung.
Die Summe der positiven Elementarladungen der Kationen und der negativen Elementarladungen der Anionen muß Null ergeben.
Das Natriumkation ist positiv einfach geladen, z= + 1.
Das Magnesiumion ist zweifach positiv, z= +2.
Das Sufation ,SO4(2-), ist zweifach negativ geladen, z= -2.
Beim Chloridion ist z= -1.
0 = (+1)*c(Na(+)) + (+2)*c(Mg(2+)) + (-1)*c(Cl(-)) + (-2)*c(SO4(2-))
$$c(SO_{4}^{(2-)}) = \dfrac{(+1)\cdot c(Na^{(+)}) + (+2)\cdot c(Mg^{(2+)}) + (-1))\cdot c(Cl^{(-)})}{2}$$
$$c(SO_{4}^{(2-)}) = \frac{1}{2}(0,486 + 2\cdot 0,051 - 0,53406) \cdot \frac{mol}{l}$$
c(SO4(2-)) = 0,05394 mol/l
Massenkonzentration der Sulfationen
Molmasse v. Sulfat (SO4(2-)) = (32,06+4*15,9994)g/mol = 96,0576 g/mol
cm(SO4(2-)) = 0,05394 mol/l * 96,0576 g/mol = 5,181 g/l
Zusammenfassung
Natrium: c= 0,486 mol/l, cm= 11,173 g/l
Magnesium: c= 0,051 mol/l, cm= 1,24 g/l
Chlorid: c= 0,53406 mol/l, cm= 18,934 g/l
Sulfat: c= 0,05394 mol/l, cm= 5,181 g/l