Hi, hier chemweazle,
Zu
sind die Produkte der Bromierungen korrekt?
1).richtig
Das Produkt bei der Elektrophilen Substitution (SE-Reaktion) mit Brom an Anisol(Methoxybenzol), ist ortho-Brom-Anisol(2-Brom-methoxybenzen).
Katalysator: Fe0 + Br2 → FeBr2
Das ist korrekt, vielleicht entsteht auch etwas von dem para-Isomer.
4-Brom-methoxybenzen(p-Brom-Anisol).
4-Br-C6H4-O-CH3

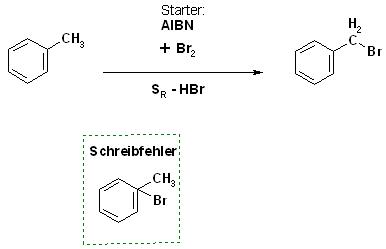
2). richtig, nur kleiner Schreibfehler
Bei der Radikalischen Substitution(SR-Reaktion) mit Brom an Toluol(Toluen) entsteht das Benzylbromid, mit AIBN oder ABIN als Radikalstarter .Das ist richtig.
Allerdings ist ein kleiner Schreibfehler beim Produkt, dem Benzylbromid aufgetreten: Das Br-Atom sitzt am Aromat und nicht an der Seitenkette.
3). Halogenierung in Alpha-Position von Carbonylverbindungen, Aldehyde, Ketone
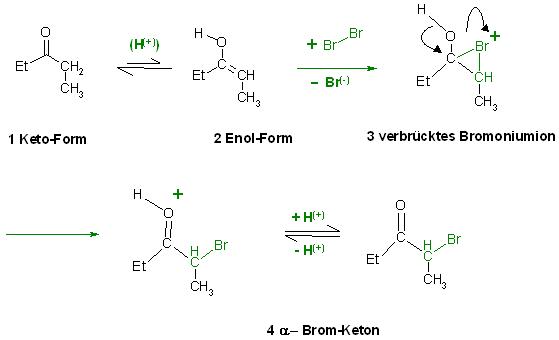
Es entsteht bei der Bromierung auf nicht radikalischen Wege auch die α-Bromverbindung von Pentan-3-on, α-Brom- Pentan-3-on.
Produkt: CH3-(CH)Br-CO-CH2-CH3
Die Säure katalysiert nur die Enolisierung, verschiebt aber nicht das Tautomerengleichgewicht in Richtung Enol.
Das Brom addiert sich an die C-C-Doppelbindung der Enol-Form des Ketons, wie bei einem gewöhnlichen Alken unter Bildung eines verbrückten, dreigliedrig cyclischen, Bromoniumions. Dies aber besitzt eine OH-Gruppe als Seitenkette. Der Sauerstoff schlägt nun wieder die Doppelbindung ein zum Carbonyl-C-Atom der Keto-Gruppe und der Ring des verbrückten Bromoniumions reißt auf.
Mechanismus
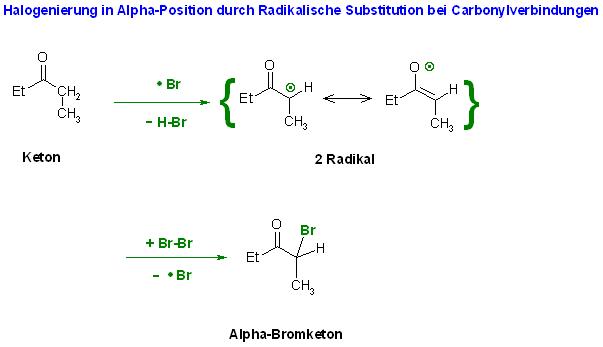
Da gibt es noch die Halogenierung von Carbonylverbindungen in Alpha-Position durch Radikalische Substitution.
Aldehyde, Ketone, Ester vielleicht auch Nitrile
Das Halogenatom abstrahiert in Alpha-Postion der Carbonylverbindung ein H-Atom. Das Radikal reagiert dann in der Propagation mit einem Halogenmolekül unter Bildung der Alpha-Halogencarbonylverbindung.
Mechanismus
Grüße chemweazle