Hi, hier chemweazle,
2-Chlor-2-methyl-propan (tert. Butylchlorid) kann mit Natriummethanolat theoretisch zu einem Ether und einem Stoff X, der sich mit Bromwasser nachweisen lässt, reagieren. In der Realität kommt es fast ausschließlich zur Bildung von Stoff X.
1.1 Formuliere die Reaktionsgleichungen zur Bildung des Ethers und des Stoffes X und benenne die jeweiligen Reaktionsmechanismen.
Ethersynthese nach Williamson
Reaktionstyp: Nucleophile Substititution, Mechanismen(Monomolekulare Nucleophile Substitution, SN1, Unimolekulare Nucleophile Substitution, seltener Dissoziative Nucleophile Substitution genannt, mit der Carbeniumionbildung als Zwischenprodukt im 1. Reaktionsschritt, und die bimolekulare Nucleophile Substitution, SN2, seltener auch Assoziative Nucleophile Substitution genannt, die nur ausschließlich unter Rückseitenangriff des Nucleophils abläuft.
Allgemeine Reaktionsgleichung für die gewünschte Umsetzung
CH3-OI(-) + (CH3)3C-Cl ⇌ CH3-O-C(CH3)3 + Cl(-)
Nucleophil, Eintrittsgruppe: Methanolat, veraltet Methylat, CH3-OI(-)
Nucleofug, Abgangsgruppe, Austrittsgruppe: Chloridion, Cl(-)
Beta-Eliminierung, β-Eliminierung, Dehydrohalogenierung
CH3ONa + H-CH2-C(CH3)2-Cl → CH2=C(CH3)2 + CH3OH + NaCl
CH3-OI(-) + H-CH2-C(CH3)2-Cl ⇌ CH3-O-H + 2HC=C(CH3)2 + Cl(-)
Mechanismen: 2 Typen:
1. Monomolekulare Eliminierung mit der Bildung des Zwischenproduktes eines Carbeniumions, E1-Reaktion. Der langsamste Schritt ist die Bildung des Carbeniumions durch Abspaltung eines Chloridions, wie bei der SN1-Reaktion. Diese Reaktion ist oft die Konkurenzreaktion, Parallelreaktion zur SN1-Reaktion.
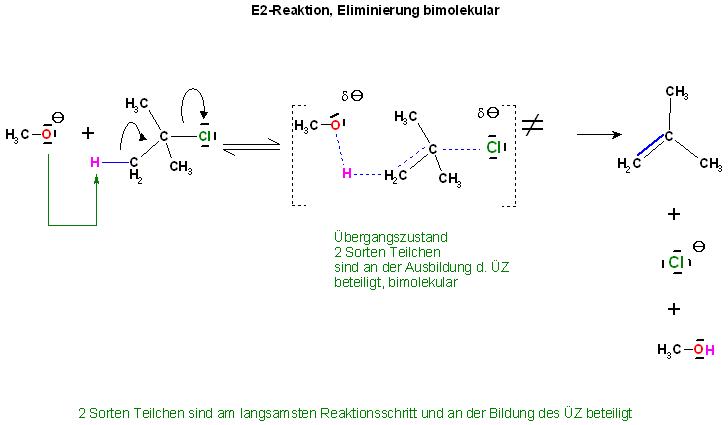
2. Bimolekulare Eliminierung, 2 Sorten von Teilchen sind am langsamsten Reaktionsschritt und an der Ausbildung des Übergangszustandes, Aktivierter Komplex beteiligt. Es sind die Base, hier das Alkoholat und das Halogenalkan. Es können auch je nach Lösungsmittel und Temperatur auch beide Mechanismen nebeneinander ablaufen.
Verbindung X:
Name des durch die Eliminierung entstandenen Alkens(Olefin): 2-Methyl-1-Propen, Trivialname: Isobuten
Warum überwiegt hier das unerwünschte Eliminierungsprodukt?
1. Das Nucleophil ist ein Alkoholat, Natriumethanolat, das ist schon eine Superbase, diese ist stärker als OH(-)-ionen im gleichen Lösungsmittel.
Einerseits ist die Eliminierungsreaktion durch die starke Basizität des Nucleophils begünstigt.
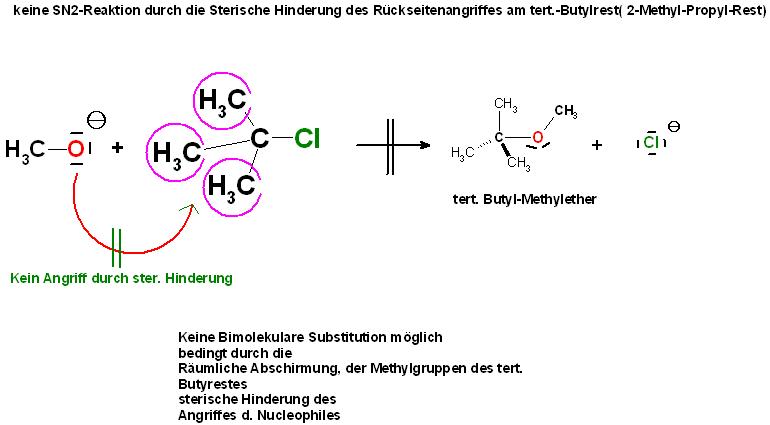
2. Zusätzlich ist, im Falle einer SN2-Reaktion, der Rückseitenangriff des Nucleophils am C-Atom mit dem Chloratom des 2-Methyl-Propyl-Restes, auch tert. Butylrest genannt,durch die sperrigen 3 Methylgruppen räumlich gehindert, Sterische Hinderung. (siehe Skizze weiter unten)
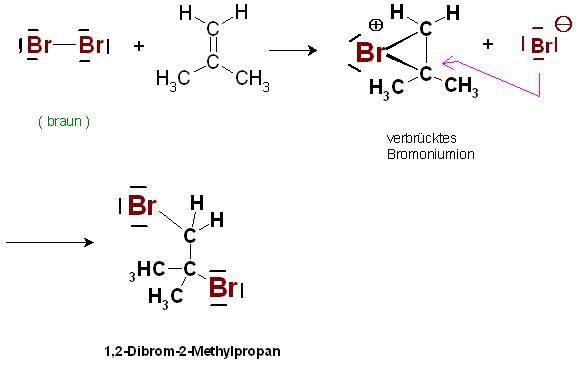
3. Zur Entfärbung des Bromwassers, wäßrige Bromlösung mit brauner Farbe
Grober Hinweis auf das Vorhandensein von C-C-Doppelbindungen, nicht spezifischer Nachweis für Alkene.
Die in Wasser gelösten Brommoleküle bedingen die braune Farbe. Bei der Addition der Brommoleküle an die C-C-Doppelbindungen eines Alkens entsteht die farblose Dibrom-Alkanverbindung.
Beispiel: Halogenaddition, Bromadditon an die C-C-Doppelbindung von Alkenen
2HC=C(CH3)2 + Br-Br(braun) → HBrC-CBr(CH3)2(farblos)
Produkt: 1,2-Dibrom-2-Methyl-Propan
Mechanismus: siehe unten
Reaktionsmechanismen
SN1 und E1- Reaktionen
Unimolekulare, Monomolekulare, Nucleophile Substitution, auch Dissoziative Nucleophile Substitution genannt und die Unimolekulare, Monomolekulare Eliminierungsreaktion
Beide Reaktionen, die Substitution und die Eliminierung laufen je nach Art des Nucleophils und nach Art des Lösungsmittels oft nebeneinander, konkurrierend ab.
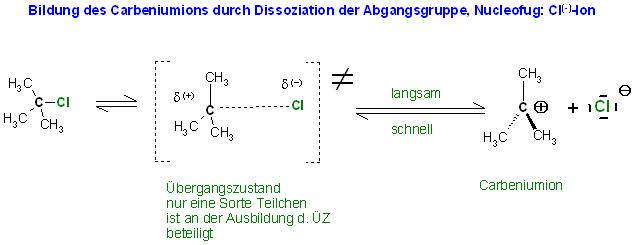
Der 1. Teilschritt ist bei beiden Reaktionen die Bildung eines Carbeniumions, hier im Beispiel das 2-Methyl-Propylkation, auch tert. Butylkation genannt.
Das Nucleofug, die Abgangsgruppe spaltet sich als Anion ab. Dabei wird das Carbeniumion als Gegenion gebildet. Diese heterolytische Spaltung erfordert sehr viel Aktivierungsenergie. Deshalb ist der Übergangszustand, Aktivierter Komplex, sehr energiereich und deshalb ist dieser Reaktionsschritt sehr langsam. Die Umkehrreaktion, das Einfangen des ausgetretenen Nucleofugs, die Rekombination von Carbeniumion und Nucleofug ist dagegn eine schnelle Reaktion.
An dem langsamsten Reaktionsteilschritt, der Dissoziation des Nucleofugs ist nur eine Sorte Teilchen, hier das Halogenalkan beteiligt. Auch wird der Übergangszustand für den Dissoziationsschritt nur durch eine Molekülsorte, dem Halogenalkan gebildet.
Skizze
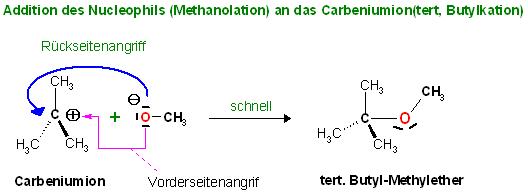
Das Carbeniumion kann nun auch das Nucleophil einfangen. Hier im Beispiel fängt das tert.-Butylkation das Methanolation ab. Die Addition des Nucleophils kann von 2 Seiten am positiv geladenen C-atom des Carbeniumions erfolgen. Dabei würde der gewünschte Ether, 2-Methyl-Propyl-Methylether entstehen.
Skizze
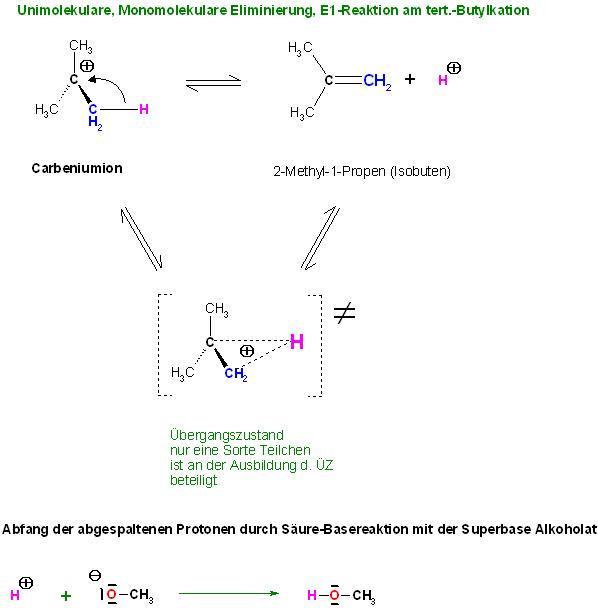
Ein anderer Teil der Carbeniumionen geht die E1-Reaktion ein. Dabei klappt ein Elektronenpaar an einem benachbarten C-Atom zum positiv geladen C-Atom hin und dabei entfernt sich ein Proton.
Carbeniumionen können jeweils ein Proton abspalten unter Ausbildung einer C-C-Doppelbindung. Es bildet sich ein Alken. Die Protonenabspaltung kann auch ohne Anwesenheit einer Base erfolgen.
In saurer Lösung stehen Carbeniumionen und Alken im dynamischen Gleichgewicht.
Hier im Beispiel ist Methanolat, eine Superbase anwesend. Das begünstigt die Eliminierung erheblich.
Skizze
SN2 und E2-Reaktion
Bimolekulare, Assoziative Nucleophile Substitution
Das Nucleophil, die Eintrittsgruppe, kann aus räumlichen Gründen nur von der Hinterseite, Rückseite am C-Atom mit der Abgangsgruppe angreifen.
Am langsamsten Reaktionsteilschritt sind 2 Reaktionspartner, 2 Sorten Teilchen beteiligt.(Molekularität = 2)
Der Übergangszustand wird aus 2 Teilchen gebildet, Molekularität=2. Es sind die Reaktionspartner: Nucleophil und das Halogenalkan.
Wie oben erwähnt ist die SN2-Reaktion zwischen dem tert. Butylchlorid und dem Methanolation aus sterischen Gründen nicht möglich. Die Methylgruppen schirmen das elektrophile C-Atom-mit dem Chloratom, das Reaktionszentrum, räumlich ab. (sterical hindrance)
Skizze
Bei der bimolekularen Eliminierung sind 2 Teilchensorten am langsamsten Schritt(geschwindigkeitsbestimmenden Schritt) beteiligt. Es sind die beiden Reaktionspartner Base und das Halogenalkan, hier im Beispiel das Methanolation und das tert.-Butylchlorid(2-Methyl-2-Chlor-Propan). Der Übergangszustand für die Elimierung wird aus den 2 Sorten Teilchen gebildet. Deshalb ist die Molekularität gleich 2.
Die Abspaltung von Methanol und dem Chloridion verläuft am Übergangszustand gleichzeitig, synchron.
Skizze
Mechanismus der Halogenaddition an Alkene:
1. Teilreaktion, Bildung der "verbrückten Bromoniumionen" plus den Bromidionen
Es wird zunächst in der ersten Teilreaktion ein dreiring-förmiges Kation, das sog. verbrückte Haloniumion, hier im Beispiel mit Brom, das verbrückte Bromoniumion, mit einem Bromidion als Gegenion gebildet.
2. Teilreaktion, Addition der Bromidionen an ein C-Atom der "verbrückten Bromoniumionen"
Im 2. Teilreaktionsschritt addiert sich das Bromidion, das Anion(Gegenion) von der Rückseite( Unterseite ) des Dreiring-Kations(Bromoniumion).
Skizze