Gruß chemweazle,
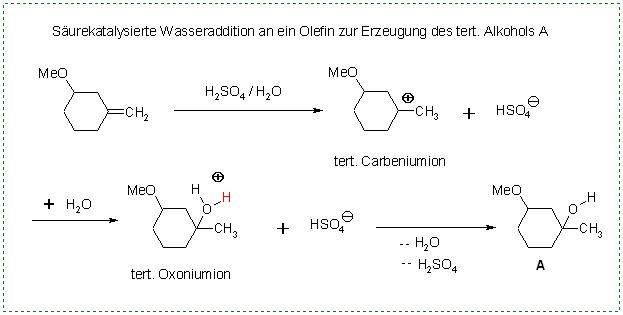
1. Reaktion Olefin(Alken) ergibt durch säurekatalysierte Wasseraddtion den tert Alkohol A. Als Zwischenprodukt wird ein Carbeniumion gebildet und durch den anschließenden Wasseradditionsschrittt mit abschließender Deprotonierung wird der tert. Alkohol A gebildet.
Me-O-CH-(CH2)4C=CH2 + H(+) ⇌ Me-O-CH-(CH2)4(C(+))-CH3
Me-O-CH-(CH2)4(C(+))-CH3 + H2O ⇌ Me-O-CH-(CH2)4(C-OH2(+))-CH3
Me-O-CH-(CH2)4(C-OH2(+))-CH3 ⇌ Me-O-CH-(CH2)4(C-OH)-CH3 + H(+)
Bild
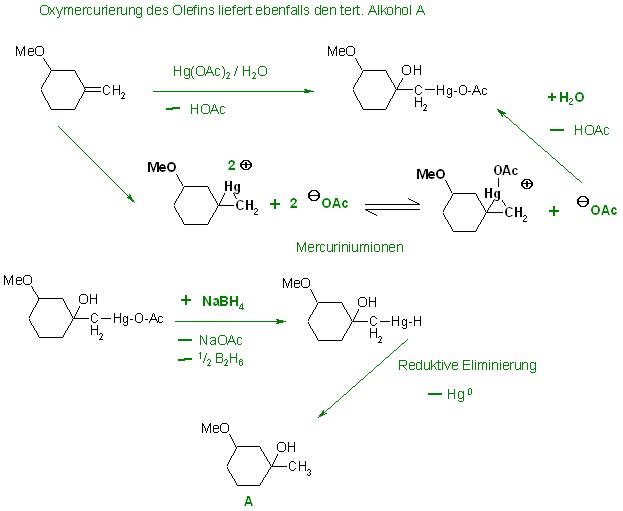
Die Oxymercurierung liefert mit dem Olefin ebenfalls den tert. Alkohol A.
Bei der Umsetzung des Olefines mit Quecksilber(II)acetat als Elektrophil und Wasser ergibt sich als Zwischenprodukte das quecksilberverbrückte, dreigliedrige, ringförmige Mercuriniumion bzw. das Mercuriniumacetat. An diesen metallverbrückten, dreiringförmigen Mercuriniumionen wird von der Rückseite an das olefinische tert. C-Atom, welches Ringglied ist, Wasser addiert.
Ein Equivalent Acetationen fängt ein eq. Protonen beim Deprotonierungsschritt der nach der Wasseraddition enstehenden Oxoniumionen ab.
Es entsteht nun ein tert. Alkohol, der am 2ten C-Atom mit einem Quecksilberatom metalliert ist . Das Quecksilber(II)-Atom ist mit einem Kohlenstoffatom und einem Acetatrest verbunden.
Me-O-CH-(CH2)4C(OH)-CH2-Hg-OAc
Zugabe von Natriumboranat(Natriumborhydrid) fängt einerseits die Essigsäure im Gemisch auf und ersetzt den Acetoxyrest am Quecksilberatom durch ein Hydridion, dabei wird Boran(Diboran als Nebenprodukt) frei.
Me-O-CH-(CH2)4C(OH)-CH2-Hg-OAc + NaBH4 → Me-O-CH-(CH2)4C(OH)-CH2-Hg-H + NaOAc + 1⁄2 B2H6(g) ↑
Die Reduktive Eliminierung an der Hydrido-Organo-Quecksilberverbindung bezüglich des Quecksilbers liefert unter Abspaltung der Quecksilberatome den tert. Alkohol A ohne Metall.
Me-O-CH-(CH2)4C(OH)-CH2-Hg-H → Me-O-CH-(CH2)4C(OH)-CH2-H + Hg0
Bild
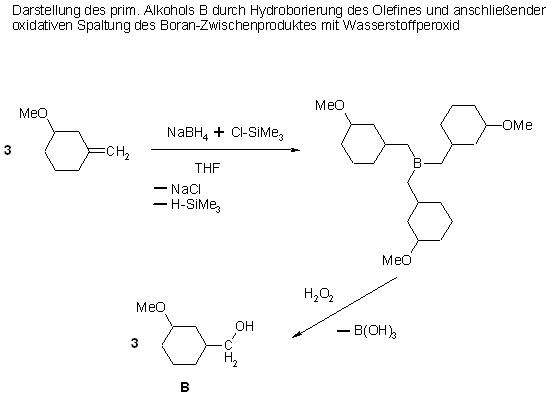
2. Durch Hydroborierung entsteht aus dem Olefin ein prim. Triboran. Das Zwischenprodukt Boran wird oxidativ an den 3 Bor-Kohlenstoffbindungen mit Wassserstoffperoxid zu Borsäure und dem prim. Alkohol B gespalten.
Bild Hydroborierung, oxidat Spaltung des Borans mit H2O2
3. Grignard-Addition-Substitution an einem Ester zur Darstellung eines tert. Alkohols.
Der Benzoësäuremethylester liefert durch Umsetzung mit 4eq. Methylmagnesiumiodid letztlich das Alkoholat und nach anschließender Hydrolyse des überschüssigen Grignardreagenzes und des Magnesiumalkohaltes den tert. Alkohol.
Als Zwischenprodukt entsteht zunächst das Methylphenylketon(Acetophenon), welches durch Addition eines weiteren Equivalentes Methyl-Magnesium-Iodid das tert. Magnesiumalkoholat liefert.
Ph-(C=O)-O-Me + 4 CH3-Mg-I → Ph-(C=O)-CH3(Zwischenprodukt Acetophenon) + Me-O-Mg-I + 3 CH3-Mg-I
Ph-(C=O)-CH3(Zwischenprodukt Acetophenon) + 3 CH3-Mg-I → PhC(CH3)2-O-Mg-I + 2 CH3-Mg-I
Hydrolyse mit n-Propanol und Wasser
PhC(CH3)2-O-Mg-I + 2 CH3-Mg-I + 3 n-Pr-OH → PhC(CH3)2-O-H + 3 n-Pr-O-Mg-I + 2 CH4(g) ↑
3 n-Pr-O-Mg-I ⇌ 3⁄2 MgI2 + 3⁄2 Mg(OPr-n)2
Mg(OPr-n)2 + 2 H2O → Mg(OH)2 + 2 nPr-OH
4. Weinreb-Ketonsynthese
Das Weinreb-Amid der Benzoësäure, das Benzoyl-N-Methoxy-N-Methylamid wird mit n-Propyl-Lithium zum 1-Phenylpropanon unter Abspaltung des Lithium-N-Methoxy-N-Methylamids umgesetzt.
Ph-(C=O)-N(CH3)-O-CH3 + n-Pr-Li → Ph-(C=O)-Pr-n(Keton) + LiN(CH3)-O-CH3
:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
5.
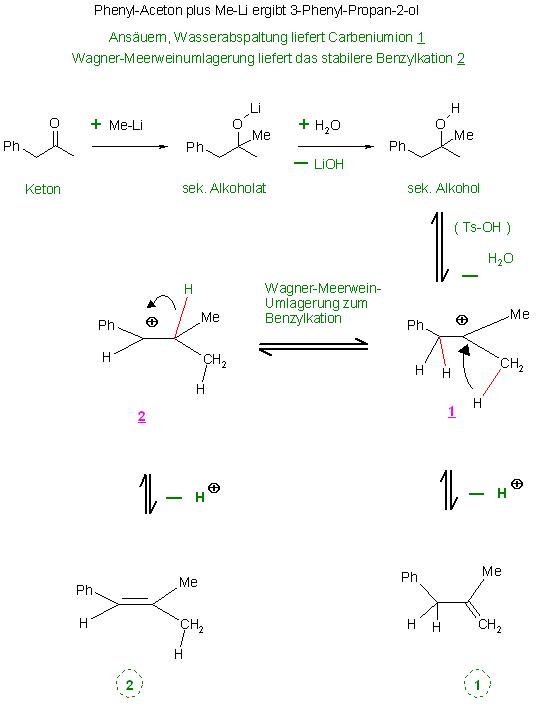
Reaktion von der stark CH-aciden Verbindung Phenylaceton mit der Superbase MeLi soll, bestimmt mit Seitenreaktionen, nach anschließender Wasserabspaltung des primär gebildeten Alkohols (diese beiden Alkene 1 und 2 liefern. Eigentlich müßten 2 verschiedene Lithiumenolate durch Säure-Base-Reaktion gebildet werden, die dann mit restlichen Phenyaceton Ketoladditionen und Ketolkondensationen eingehen müßten.
Schritt 1, Addition von Methyllithium an die Ketogruppe liefert das Lithiumalkoholat
Ph-CH2-(C=O)-CH3 + CH3-Li → Ph-CH2-(C-O-Li)-(CH3)2
Schritt 2, Freisetzung des Alkohols durch Säure-Base-Reaktion mit Alkohol-Wasser aus dem Alkoholat
Ph-CH2-(C-O-Li)-(CH3)2 + EtOH → Ph-CH2-(C-O-H)-(CH3)2 + LiO-Et
Schritt 3, säurekatalysierte Wasserabspaltung am Alkohol, Carbeniumionbildung
( Katalysator: H(+) aus TsOH, para-Toluensulfonsäure )
Ph-CH2-(C-O-H)-(CH3)2 + H(+) ⇌ Ph-CH2-(C(+))-(CH3)2 + H2O
Wagner-Meerwein-Umlagerung des homobenzylischen Carbeniumions zum Benzylkation
Ph-CH2-(C(+))-(CH3)2 ⇌ Ph-(CH(+))-(CH)-(CH3)2
E1-Reaktionen(Protonenabspaltungen) der beiden im Gleichgewicht befindlichen Carbeniumionen zu den beiden konstitutionsisomeren Olefinen 1 und 2.
Ph-CH2-(C(+))-(CH3)2 ⇌ Ph-CH2-(C=CH2)-CH3 (Alken 1) + H(+)
Ph-(CH(+))-(CH)-(CH3)2 ⇌ Ph-(CH=(C)-(CH3)2 (Alken 2) + H(+)
Bild Phenylaceton mit MeLi zum Alkohol und anschl Wasserabspaltung E1-Rkt. zu den Alkenen