Gruß chemweazle,
Reaktionsmechanismen für die heterogen katalysierte, reversible Addition von Wasserstoff an Alkene, säurekatalysierte Wasseraddition und der Hydrohalogenierung an Olefine
Anmerkung: Den Reaktionsmechanismus der heterogen-katalysierten Syn-Addition von Wasserstoff an Alkene und alkine oder an andere Substanzen mit Mehrfachbindungen formuliere ich hier nicht.
Ich habe noch nicht pasende Skizzen hierzu angefertigt.
Von den Reaktionsmechanismen paßt die Hydrierung nicht zu den Mechanismen der Additionen an Carbeniumionen.
Die katalyt. Hydrierung ist ein Sonderthema.
• 2) Formuliere den Reaktionsmechanismus der...
a) Hydrierung von Ethen (syn-Addition von Wasserstoff an Doppel- und Dreifachbindungen)
Reaktionsgleichung
| Kat.: (Pt0, Pd0, Ni0 | |
| CH2=CH2 + H-H | ⇌ | H-CH2—CH2-H |
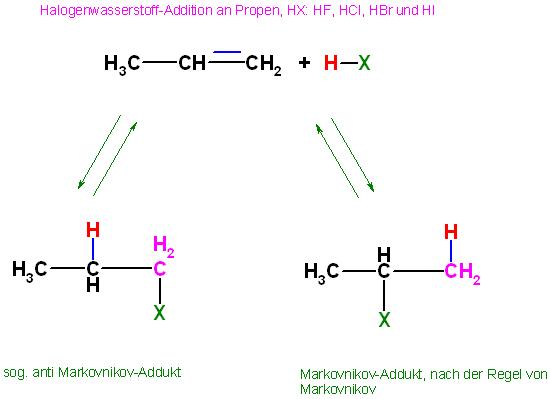
zu b). Die H-X-Addition an Propen
b) Hydrohalogenierung von Propen (Addition von Halogenwasserstoffen) und die Regel von Markovnikov
| CH3-CH=CH2 | + | H-X |
| CH3-CH(-X)-CH2-H | und | CH3-CH(-H)-CH2-X |
| 2 Halogenpropan | | 1-Halogenpropan |
| "Markovnikov-Addukt" | | "Anti-Markovnikov-Addukt" |
zu b). Die H-X-Addition an Propen
Es sind 2 Produkte ( Halogenalkane ) ausgehend von Propen und Halogenwasserstoff denkbar, es sind:
Das Hauptprodukt
2 Halogenpropan(Isopropylhalogenid), das nach der Regel von Markovnikov entsteht
Das Nebenprodukt
1 Halogenpropan, das sogenannte "anti Markovnikov- Produkt" in geringen Umfang
Die Markovnikov-Regel
Bei substituierten Alkenen addiert sich der Halogenwasserstoff, HX, entsprechend der Regel von Markovnikov mit dem Wasserstoffatom, H-Atom, an das C-Atom der C-C-Doppelbindung mit den meisten H-Atomen. Das ist hier im Beispiel beim Propen die =CH2-Gruppe. Das Halogenatom wird dann nach der Regel von Markovnikov an das C-Atom der C-C-Doppelbindung mit der geringsten Anzahl an H-Atomen addiert.
Das ist im Beispiel von Propen die CH=-Gruppierung.
Das 2- Halogenpropan ist in der Tat das Hauptprodukt, wenn nicht gar das einzige Produkt.
Das 1 Halogenpropan, das sog. "Anti-Markovnikov-Addukt" entsteht nur in sehr geringer Menge oder gar nicht.
Die Methylgruppe im Propen ist ein Donor-Substituent, sie übt einen positiven Induktiven Effekt(+I-Effekt) aus.
Bei Alkenen mit +I-Substituenten gilt die Markovnikov-Regel.
Skizze zur Gesamtreaktion
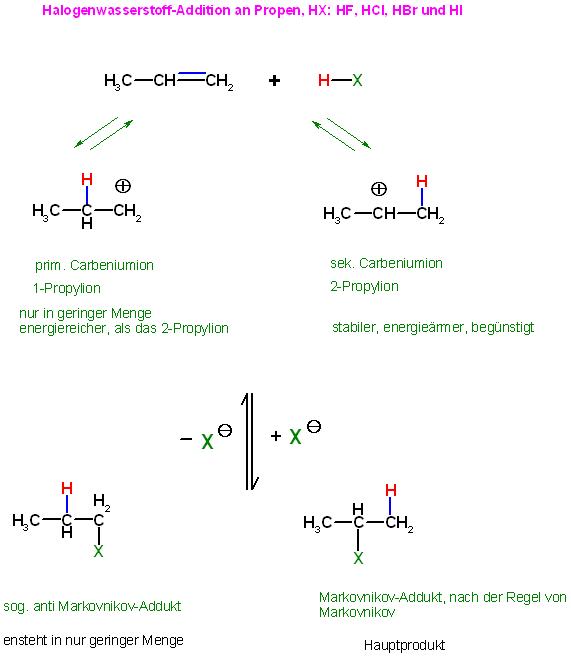
•Mechanismus der HX-Addition an Propen bzw. die HX-Eliminierung an Halogenpropan
1. Teilschritt, die reversible Protonierung des Propens zum Carbeniumion
Esind 2 Sorten von Carbeniumionen denkbar, die bei der reversiblen Protonierung von Propen entstehen können.
Das sek. Propyl-Kation, "Isopropylkation" ist das energieärmere(satbilere) der beiden denkbaren Propyl-Kationen. Während das prim. Propyl-Kation, das 1-Propyl-Kation das energiereichere(instabilere) Kation wäre.
Die Stabilisierung der Kationen (Carbeniumionen) kann man sich klassisch mit dem +I-Effekt oder moderner mit der Hyperkonjugation(Natan-Baker-Effekt, Agostisc he Wechselwirkung mit den Methylgruppen) erkläre.
2. Teilschritt, die reversible Addition der Halogenidionen an die Carbeniumionen, Assoziation von Carbeniumion mit Halgenid
1. Protonierung, Deprotonierung von Propen
CH3-CH=CH2 + H-X ⇌ CH3-CH⊕-CH2-CH(-H)-CH2⊕ + X⊖
2. Assoziation von Carbeniumionen und Halogenidionen
CH3-CH⊕-CH2-CH(-H)-CH2⊕ + X⊖ ⇌ CH3-CH(-X)-CH2-H und CH3-CH(-H)-CH2-X
Skizze Mechanismus der HX-Addition an Propen bzw. Die HX-Eliminierung an den Halogenalkanen
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
Einschub
• Die Energiearmut(sog. Stabilität), der Carbeniumionen im Vergleich
Unter Energie wird die Gesamtenergie, Summe aus potentieller und kinetischer Energie, aller Elektronen im jeweilig betrachteten Carbeniumion verstanden.
Das sog. "Stabilere Carbeniumion", so heißt es im Jargon, ist das mit der geringeren Gesamtenergie der Elektronen(Elektronische Gesamtenergie).
Das energieärmere, im Jargon stabilere, Carbeniumion ist das, bei welchem das postiv geladene C-Atom durch die benachbarten Alkylsubstituenten Elektronenschub entlang der C-C-Bindungungen erhält. (+ I-Effekt )
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
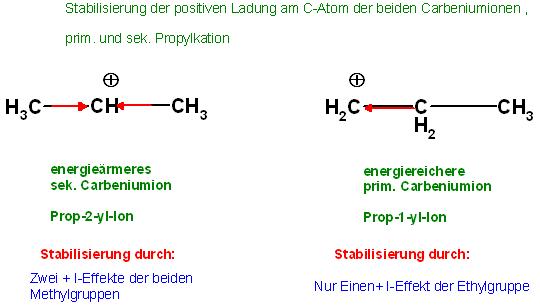
a). Das energieärmere 2- Propylkation
Das Prop-2-yl-Kation ist durch den +I-Effekt der beiden Methylgruppen, CH3-Gruppen, etwas energieärmer, als das prim. Carbeniumion, Prop-1-yl-Kation.
b). Das energiereichere 1- Propylkation
Das positiv geladene C-Atom beim Prop-1-yl-Kation erfährt nur einen Elektronenschub von der benachbarten CH2-Gruppe oder vom gesamten Ethylrest, -CH2-CH3.
Beim sek.Propylion erfährt das positiv geladene C-Atom fast den doppelten +I-Effekt von den 2 benachbarten Methylgruppen.
Die + I-Effekte an beiden Carbeniumionen
prim. Carbeniumion, energiereicher, nur 1 Stabilisierung der pos. Ladung durch einen + I-Effekt des benachbarten Ethylrestes(←CH2-CH3)
⊕CH2←CH2-CH3
sek. Carbeniumion, energieärmer, stabiler, als das prim. Carbeniumion
CH3→⊕CH←CH3
Skizze
Alternativ und etwas moderner läßt sich die Stabilisierung der beiden Carbeniumionen durch die Hyperkonjugation erkären.
c) Hydratisierung von Ethen (Addition von Wasser)
Hinweis: Dieser Mechanismus gelingt nur säurekatalysiert, begründe dies!
Die Elektrophilie des Ethens reicht nicht für den nucleophilen Wasser-Additions-Schritt aus.
Die säurekatalysierte Addition von Wasser an Alkene muß in verdünnter Säurelösung durchgeführt werden. Das ist notwendig, damit die durch die Protonierung entstandenen Carbeniumionen hauptsächlich mit Wassermolekülen zusammenstoßen . In konzentrierteren Säure-Lösungen hingegen stoßen die gebildeten Carbeniumionen auch mit den Anionen der eingesetzten Säure zusammen.
Dabei bilden sich im Falle von HCl 1-Chlorethan, im Falle mit Schwefelsäure Diethylsulfat.
1. Schritt Protonierung des Alkens, Bildung des Carbeniumions
CH2=CH2(aq) + H⊕ ⇌ H-CH2-CH2⊕ (CH3-CH2⊕ )
Diese Reaktion ist umkehrbar. Die Hin-Reaktion ist die Protonierung des Alkens zum Carbeniumion; hier im Beispiel das Ethylkation, die Rück-Reaktion ist die Deprotonierung des Carbeniumions zum Alken.
2. Schritt Nucleophile Addition des Wassers an das entstandene Carbeniumion
| CH3-CH2⊕ + OH2 | ⇌ | CH3-CH2-OH2⊕ | ⇌ | CH3-CH2-OH + H⊕ |
| Ethylkation, Carbeniumion | | Ethyl-Oxoniumion | | Ethanol |