Grüße chemweazle,
Ermitteln Sie die Konzentration der Calcium-Ionen in der Wasserprobe und geben Sie die Wasserhärte an
Aufgabe:
Konduktometrische Titration, Leitfähigkeits-Titration von Calciumionen mit Oxalsäure-Maßlösung zur Fällung der Calciumionen als schwerlösliches Oxalat
Das Volumen des Aliquots: V(Wasserprobe) = 200 ml = 1/5 l
Maßlösung: 0,1 m-Oxalsäure-Lsg.
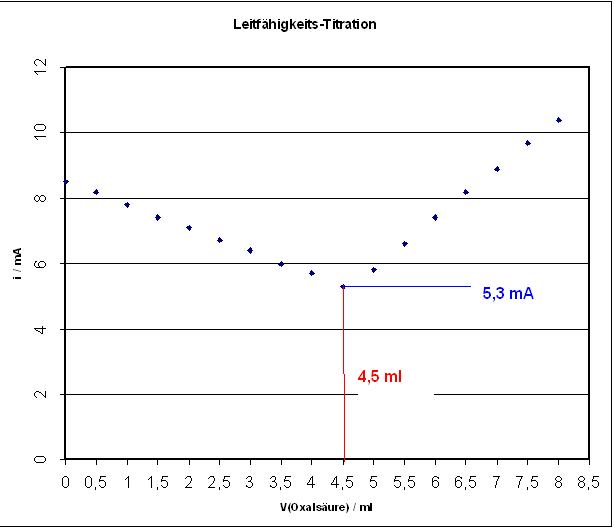
| V(Oxalsäure) in ml | 0,0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | 7,0 | 7,5 | 8,0 |
| I in mA | 8,5 | 8,2 | 7,8 | 7,4 | 7,1 | 6,7 | 6,4 | 6,0 | 5,7 | 5,3 | 5,8 | 6,6 | 7,4 | 8,2 | 8,9 | 9,7 | 10,4 |
Text erkannt:
Leitfähigkeits-Titration
Der Strom der durch die Leitfähigkeit der Lösung bedingt wird, ist direkt proportional zur Konzentration der Calciumionen.
Bei fortschreitender Zugabe der Oxalsäure-Maßlösung werden zunehmends Calciumionen durch die Fällungsreaktion entfernt. Die Calciumionenkonzentration nimmt ab. Somit sinkt auch der gemessene Strom bis hin zum ÄP. Am Äquivalenzpunkt hat die Konzentration der Calciumionen ihr Minimum erreicht. Deshalb sind der Leitwert und der Strom minimal.
Bei weiterer Zugabe von überschüssiger Oxalsäure steigen die Leitfähigkeit und somit der gemessene Strom wieder an.
Ab dem ÄP trägt die Oxalsäure, die in der Erstdissoziation eine mittelstarke Säure ist, erheblich durch die besonders schnell beweglichen H(+)-Ionen und den Hydrogenoxalat- und Oxalationen zur elektrischen Leitfähigkeit bei.
Fällungs-Reaktion
Ca(2+)(aq) + HOOC-COOH → CaC2O4(s) ↓ + 2 H(+)(aq)
ÄP
Strom-minimum, i = 5,3 mA und V(Oxalsäure-Maß-Lsg.) = 4,5 ml
Beim Erreichen des ÄP wurde die gleiche Stoffmenge an Oxalsäure-Molekülen zugegeben, wie Calciumionen in der Lösung der Probe vorlagen.
Stoffmengengleichheit, Stoffmengenäquivalenz, beim ÄP.
n(Oxalsäure)zugegeben = n(Ca(2+))im Aliquot
V(Oxalsäure-Maß-Lsg.) = 4, 5 ml und c(Oxalsäure-Maß-Lsg.) = 0,1 mol / l = 0,1 mmol / ml
n(Oxalsäure)zugegeben = c(Oxalsäure-Maß-Lsg.) * V(Oxalsäure-Maß-Lsg.) = 0,1 ( mmol / ml ) * 4,5 ml = 0,45 mmol = n(Ca(2+))im Aliquot
Es lag vor der Titration eine Stoffmenge von 0,45 mmol an Calciumionen in dem Aliquotvolumen von 200 ml vor.
Die Konzentration an Calciumionen im Aliquot, beträgt 0,45 mmol auf einen Fünftel Liter.
Das Internationale Härtegradmaß: Stoffmenge an Calciumionen in mmol pro 1 Liter Lösung.
$$c(Ca^{(2+)}) = \dfrac{n(Ca^{(2+)})}{V(Aliquot)} = \frac{0,45\cdot mmol}{0,2\cdot l} = \frac{5\cdot 0,45\cdot mmol}{l} = \frac{2,25\cdot mmol}{l}$$
Es liegen 2,25 mmol an Calciumionen in einem Liter vor.
Das Deutsche Härtegrad-Maß, abgekürzt mit dH, verwendet die Masse an Calciumoxid, gemessen in mg, auf 100 ml Volumen.
Nun muß man die Stoffmenge an Calciumionen in 100 ml = 0,1 l berechnen und mit der Molmasse von CaO multiplizieren. Dann diese Masse noch von der Einheit g in mg umwandeln. Die Anzahl Milligramm pro 100 ml sind dann mit der Einheit [dH] zu versehen.
$$1 dH = \frac{1\cdot mg}{100\cdot ml}$$
Molmasse von CaO , M(CaO) = (40,08+15,9994) / mol = 56,0794 g / mol = 56,0794 mg / mmol
In einem Zehntel Liter = 0,1 l = 100 ml liegt eine Stoffmenge an Calciumionen von 0,225 mmol vor.
$$n(Ca^{(2+)}) = \frac{2,25\cdot mmol}{l}\cdot 0,1\cdot l = 0,225\cdot mmol$$
$$m(CaO) = n(Ca^{(2+)})\cdot M(CaO) = 0,225\cdot mmol\cdot \frac{56,0794\cdot mg}{mmol} \approx 12,62\cdot mg$$
Das ergibt 12,62 mg an fiktiven Calciumoxid auf ein Volumen von 100 ml = 0,1 l.
Der Deutsche Härtegrad beträgt dann 12,62 mg⁄100 ml = 12,62 dH